지식 기반에서 좋은 작업을 보내는 것은 간단합니다. 아래 양식을 사용하세요
연구와 업무에 지식 기반을 활용하는 학생, 대학원생, 젊은 과학자들은 여러분에게 매우 감사할 것입니다.
게시 날짜 http://www.allbest.ru/
소개
주기율표의 VII족에는 망간, 테크네튬, 레늄, 보륨뿐만 아니라 오래된 명명법에 따르면 불소, 염소, 브롬, 요오드, 아스타틴(할로겐)이 포함됩니다.
7족 원소는 7개의 원자가 전자를 가지고 있습니다. 그들 모두는 은백색 내화 금속입니다. Mn - Tc - Re 계열에서는 화학적 활성이 감소합니다. 레늄의 전기전도도는 텅스텐의 전기전도도보다 약 4배 정도 낮습니다. 공기 중에서, 조밀한 금속 망간은 얇은 산화물 막으로 덮여 있어 가열될 때에도 더 이상 산화되지 않도록 보호합니다. 반대로 잘게 분쇄된 상태에서는 아주 쉽게 산화됩니다.
외부 에너지 준위에서 할로겐은 7개의 전자를 가지며 강력한 산화제입니다. 금속과 상호작용하면 이온 결합이 일어나고 염이 형성됩니다. 전기음성도가 더 높은 원소와 상호작용할 때 할로겐(불소 제외)은 최고 산화 상태인 +7까지 환원 특성을 나타낼 수도 있습니다.
테크네튬과 보륨은 반감기가 상당히 짧은 방사성 물질이므로 자연에서는 발생하지 않습니다. 망간은 지구 지각의 전체 원자 수의 0.03%를 차지하는 흔한 원소 중 하나입니다.
할로겐의 경우 반응성이 높기 때문에 일반적으로 자연에서 화합물 형태로 발견됩니다. 지각에서의 유병률은 불소에서 요오드로 원자 반경이 증가함에 따라 감소합니다.
할로겐 원소 아스타틴 망간
1. 제칠주기율표의 첫 번째 그룹
1.1G용암 아래그룹 7 그룹. 할로겐
VII족의 주요 하위 그룹에는 불소, 염소, 브롬, 요오드 및 아스타틴 원소가 포함됩니다.
할로겐 (그리스어 ?lt - 소금 및 gEnpt - 탄생, 기원, 때로는 오래된 이름 할로겐이 사용됨) - D. I. Mendeleev의 화학 원소 주기율표의 VII 족 화학 원소
일부 비금속을 제외한 거의 모든 단순 물질과 반응합니다. 모든 할로겐은 에너지 산화제이므로 자연에서 화합물 형태로만 발견됩니다. 원자 번호가 증가함에 따라 할로겐의 화학적 활성은 감소합니다. 할로겐 이온 F? ,Cl? ,Br? ,나? ,에? 감소합니다.
모든 할로겐은 비금속입니다. 외부 에너지 준위에서 7개의 전자는 강력한 산화제입니다. 금속과 상호 작용하면 이온 결합이 일어나고 염이 형성됩니다. 전기음성도가 더 높은 원소와 상호작용할 때 할로겐(불소 제외)은 최고 산화 상태인 +7까지 환원 특성을 나타낼 수도 있습니다.
위에서 언급했듯이 할로겐은 반응성이 높기 때문에 일반적으로 자연에서 화합물 형태로 발견됩니다.
지각에서 이들의 유병률은 불소에서 요오드로 원자 반경이 증가함에 따라 감소합니다. 지각의 아스타틴 양은 그램 단위로 측정되며 우누셉티움은 자연적으로 존재하지 않습니다. 불소, 염소, 브롬 및 요오드는 산업 규모로 생산되며 염소의 생산량은 다른 세 가지 안정 할로겐보다 훨씬 높습니다.
자연에서 이러한 원소는 주로 할로겐화물로 발생합니다(알칼리 금속 질산염 침전물에서 요오드산나트륨이나 요오드산칼륨으로도 발생하는 요오드는 제외). 많은 염화물, 브롬화물 및 요오드화물이 물에 용해되기 때문에 이러한 음이온은 바다와 천연 염수에 존재합니다. 불소의 주요 공급원은 불화칼슘으로, 용해도가 매우 낮고 퇴적암(형석 CaF 2)에서 발견됩니다.
단순한 물질을 얻는 주요 방법은 할로겐화물의 산화입니다. 높은 양극 표준 전극 전위 E o (F 2 /F ?) = +2.87 V 및 E o (Cl 2 /Cl ?) = +1.36 V는 F 이온을 산화시킴을 보여줍니다. 그리고 씨엘? 강한 산화제를 사용해야만 가능합니다. 업계에서는 전해 산화만 사용됩니다. 불소를 생성할 때 수용액은 사용할 수 없습니다. 물은 훨씬 낮은 전위(+1.32V)에서 산화되고 생성된 불소는 물과 빠르게 반응하기 때문입니다. 불소는 1886년 프랑스 화학자 Henri Moissan이 무수 불화수소산에 용해된 불화수소칼륨(KHF 2) 용액을 전기분해하여 처음 얻었습니다.
산업계에서 염소는 주로 특수 전해조에서 염화나트륨 수용액을 전기분해하여 생산됩니다. 이 경우 다음과 같은 반응이 발생합니다.
양극에서의 반쪽 반응:
음극에서의 반쪽 반응:
Cl 2 보다 O 2 에 대한 과전압이 더 높은 전극 재료(특히 RuO 2 )를 사용하여 양극에서의 물의 산화를 억제합니다.
최신 전해조에서는 음극과 양극 공간이 고분자 이온 교환막으로 분리되어 있습니다. 멤브레인은 Na + 양이온이 양극 공간에서 음극 공간으로 이동할 수 있도록 해줍니다. 양이온의 전이는 전해조의 두 부분 모두에서 전기적 중성을 유지하는데, 그 이유는 전기분해 동안 음이온이 양극에서 제거되고(2Cl α가 Cl 2로 전환됨) 음극에 축적되기 때문입니다(OH β 형성). 이사 오? 반대 방향에서도 전기적 중성을 유지할 수 있지만 OH 이온은? Cl 2와 반응하여 전체 결과를 무효화합니다.
브롬은 바닷물에서 발견되는 브롬화물 이온을 화학적으로 산화시켜 얻습니다. I?가 풍부한 천연 염수로부터 요오드를 얻기 위해 유사한 공정이 사용됩니다. . 두 경우 모두 산화성이 더 강한 염소가 산화제로 사용되며 생성된 Br2와 I2는 공기 흐름에 의해 용액에서 제거됩니다.
표 1, 일부 속성할로겐.
1.2 불소
플루오르(lat. Fluorum), 멘델레예프 주기율표 VII족의 화학 원소인 F는 원자 번호 9, 원자 질량 18.998403의 할로겐에 속합니다. 정상 조건(0 °C; 0.1 Mn/m2 또는 1 kgf/cm2)에서 - 자극적인 냄새가 나는 연황색 가스입니다.
천연 불소는 하나의 안정한 동위원소 19 F로 구성됩니다. 여러 동위원소가 인위적으로 얻어졌습니다. 특히 반감기가 T S인 16 F입니다.< 1 сек, 17 F (T Ѕ = 70 сек) , 18 F (T Ѕ = 111 мин) , 20 F (T Ѕ = 11,4 сек) , 21 F (T Ѕ = 5 сек).
역사적 참고자료.최초의 불소 화합물인 형석(형석) CaF 2는 15세기 말에 "형광"이라는 이름으로 기술되었습니다(라틴어 Fluo에서 유래). 이는 야금 생산 액체의 점성 슬래그를 만드는 CaF 2의 특성 때문입니다. -흐르는). 1771년에 K. Scheele는 불화수소산을 얻었습니다. 유리 불소는 1886년 A. Moissan에 의해 산성 불화칼륨 KHF 2의 혼합물을 함유한 액체 무수 불화수소의 전기분해에 의해 분리되었습니다.
불소 화학은 1930년대에 발전하기 시작했는데, 특히 1939~45년 제2차 세계 대전 중과 그 이후 원자력 산업 및 로켓 기술의 요구와 관련하여 빠르게 발전했습니다. 1810년 A. Ampere가 제안한 "불소"(그리스어 phthoros - 파괴, 죽음에서 유래)라는 이름은 러시아어로만 사용됩니다. 많은 국가에서 "형광"이라는 이름이 허용됩니다.
자연의 불소 분포.지각(클라크)의 평균 불소 함량은 6.25·10 -2 질량%입니다. 산성 화성암(화강암)에서는 8·10 -2%, 염기성 암석에서는 3.7·10 -2%, 초염기성 암석에서는 1·10 -2%이다. 불소는 화산 가스와 열수에 존재합니다. 가장 중요한 불소 화합물은 형석, 빙정석 및 토파즈입니다. 전체적으로 80종 이상의 불소 함유 광물이 알려져 있습니다. 불소 화합물은 인회석, 인산염 및 기타에서도 발견됩니다. 불소는 중요한 생물학적 요소입니다. 지구 역사상 생물권으로 유입되는 불소의 원천은 화산 폭발(가스 등)의 산물이었습니다.
불소의 물리적 특성.기체 불소의 밀도는 1.693 g/l(0°C 및 0.1 Mn/m2 또는 1 kgf/cm2), 액체 - 1.5127 g/cm3(끓는점에서)입니다. tpl -219.61°C; 끓는점 -188.13 °C. 불소 분자는 두 개의 원자(F 2)로 구성됩니다. 1000°C에서 분자의 50%가 해리되고, 해리 에너지는 약 155kJ/mol(37kcal/mol)입니다. 불소는 액체 불화수소에 잘 녹지 않습니다. 용해도는 -70°C에서 100g HF에서 2.5·10-3g 및 -20°C에서 0.4·10-3g; 액체 형태로 액체 산소와 오존에 무제한으로 용해됩니다.
불소의 화학적 성질.불소 원자의 외부 전자 구성은 2s 2 2p 5입니다. 화합물에서는 -1의 산화 상태를 나타냅니다. 원자의 공유결합 반경은 0.72E이고, 이온 반경은 1.3ЗЕ입니다. 전자 친화력 3.62eV, 이온화 에너지(F > F+) 17.418eV. 전자 친화력과 이온화 에너지의 높은 값은 다른 모든 원소 중에서 가장 큰 불소 원자의 강한 전기 음성도를 설명합니다. 불소의 높은 반응성은 불소화의 발열 특성을 결정하며, 이는 불소 분자의 비정상적으로 낮은 해리 에너지와 불소 원자와 다른 원자의 결합 에너지의 큰 값에 의해 결정됩니다. 직접 불소화는 연쇄 메커니즘을 갖고 있어 쉽게 연소와 폭발로 이어질 수 있습니다. 불소는 헬륨, 네온, 아르곤을 제외한 모든 원소와 반응합니다. 글로우 방전에서 산소와 상호 작용하여 저온에서 불화 산소 O 2 F 2, O 3 F 2 및 기타를 형성합니다. 불소와 다른 할로겐의 반응은 발열반응으로 할로겐간 화합물이 형성됩니다. 염소는 200-250°C로 가열되면 불소와 상호작용하여 일불화염소 ClF와 삼불화염소 ClF3를 생성합니다. ClF5도 알려져 있으며, 고온 및 25Mn/m2(250kgf/cm2)의 압력에서 ClF3를 불소화하여 얻습니다. ) 브롬과 요오드는 상온에서 불소 분위기에서 발화하며 BrF 3, BrF 5, IF 3, IF 2는 크립톤, 크세논 및 라돈과 직접 반응하여 해당 불화물(예: XeF 4)을 형성합니다. , XeF 6, KrF 2 ) 크세논 옥시플루오라이드도 알려져 있습니다.
불소와 황의 상호작용은 열 방출을 동반하며 수많은 불화황이 형성됩니다. 셀레늄과 텔루르는 더 높은 수준의 불화물인 SeF 6 및 TeF 6 을 형성합니다. 불소와 수소는 연소와 반응합니다. 이것은 불화수소를 생성합니다. 이것은 라디칼 사슬 분지 반응입니다:
HF* + H 2 = HF + H 2 *; H 2 * + F 2 = HF + H + F
(HF* 및 H 2 *는 진동 여기 상태의 분자임); 반응은 화학 레이저에 사용됩니다. 불소는 전기 방전에서만 질소와 반응합니다. 숯은 불소와 상호 작용할 때 상온에서 발화합니다. 흑연은 강한 가열 하에서 그것과 반응하고 고체 불화 흑연 (CF) X 또는 기체 퍼플루오로 카본 CF 4, C 2 F 6 등의 형성이 가능합니다. 불소는 추위에 따라 붕소, 규소, 인, 비소와 반응하여 상응하는 불화물을 형성합니다.
불소는 대부분의 금속과 활발하게 결합합니다. 알칼리 및 알칼리 토금속은 차가운 불소, Bi, Sn, Ti, Mo, W 분위기에서 약간의 가열로 발화합니다. Hg, Pb, U, V는 실온에서 불소와 반응하고, Pt는 암적색 열 온도에서 반응합니다. 금속이 불소와 반응하면 일반적으로 UF 6, MoF 6, HgF 2와 같은 고급 불화물이 형성됩니다. 일부 금속(Fe, Cu, Al, Ni, Mg, Zn)은 불소와 반응하여 불소 보호막을 형성하여 추가 반응을 방지합니다.
불소가 추위에 금속 산화물과 상호 작용하면 금속 불화물과 산소가 형성됩니다. 금속 옥시불화물(예: MoO 2 F 2)의 형성도 가능합니다. 비금속 산화물은 불소를 추가합니다(예: SO 2 + F 2 = SO 2 F 2). 또는 산소가 불소로 대체됩니다(예: SiO 2 + 2F 2 = SiF 4 + O 2). 유리는 불소와 매우 느리게 반응합니다. 물이 있으면 반응이 빠르게 진행된다. 물은 불소와 상호작용합니다: 2H 2 O + 2F 2 = 4HF + O 2; 이 경우 OF 2 및 과산화수소 H 2 O 2도 형성됩니다. 질소산화물 NO 및 NO 2 는 쉽게 불소를 첨가하여 각각 니트로실 플루오라이드 FNO 및 니트릴 플루오라이드 FNO 2 를 형성합니다. 일산화탄소는 가열되면 불소를 첨가하여 불화카르보닐을 형성합니다.
CO + F 2 = COF 2.
금속 수산화물은 불소와 반응하여 금속 불화물과 산소를 형성합니다.
2Ba(OH) 2 + 2F 2 = 2BaF 2 + 2H 2 O + O 2.
NaOH와 KOH의 수용액은 0°C에서 불소와 반응하여 OF2를 형성합니다.
금속 또는 비금속 할로겐화물은 저온에서 불소와 반응하며 불소가 모든 할로겐을 대체합니다.
황화물, 질화물 및 탄화물은 쉽게 불소화됩니다. 금속 수소화물은 추위에 불소와 함께 금속 불화물과 HF를 형성합니다. 암모니아 (증기 내) - N 2 및 HF. 불소는 산의 수소 또는 염의 금속을 대체합니다. 예를 들어 HNO 3 (또는 NaNO 3) + F 2 = FNO 3 + HF (또는 NaF); 더 가혹한 조건에서는 불소가 이들 화합물에서 산소를 대체하여 설퍼릴 플루오라이드를 형성합니다. 예를 들어
Na 2 SO 4 + 2F 2 = 2NaF + SO 2 F 2 + O 2.
알칼리 및 알칼리 토금속의 탄산염은 상온에서 불소와 반응합니다. 이는 상응하는 불소, CO 2 및 O 2 를 생성합니다.
불소는 유기 물질과 격렬하게 반응합니다.
불소 획득.불소 생산원은 불화수소이며 주로 황산 H 2 SO 4 · 형석 CaF 2에 대한 작용이나 인회석 및 인회석 처리를 통해 얻습니다. 불소 생산은 산성 불화칼륨 KF-(1.8-2.0)HF 용융물의 전기분해에 의해 수행됩니다. 이는 KF-HF 용융물이 불화수소로 40-41% HF 함량으로 포화될 때 형성됩니다. 전해조의 재료는 일반적으로 강철입니다. 전극 - 탄소 양극 및 강철 음극. 전기분해는 95-100°C 및 9-11V의 전압에서 수행됩니다. 불소 전류 출력은 90-95%에 도달합니다. 생성된 불소에는 최대 5%의 HF가 포함되어 있으며, 이는 냉동 후 불화나트륨으로 흡수하여 제거됩니다. 불소는 니켈 및 이를 기반으로 한 합금(모넬 금속), 구리, 알루미늄 및 그 합금, 황동, 스테인리스강으로 만들어진 장치에 기체 상태(압력 하에서) 및 액체 형태(액체 질소로 냉각될 때)로 저장됩니다.
불소의 적용.기체 불소는 UF 4를 UF 6으로 불소화하는 데 사용되며 우라늄의 동위원소 분리는 물론 삼불화 염소 ClF 3(불화제), 육불화 황 SF 6(전기 산업의 기체 절연체) 생산에도 사용됩니다. 금속 불화물(예: W 및 V). 액체 불소는 로켓 연료용 산화제입니다.
불화수소, 불화알루미늄, 불화규소, 플루오로술폰산(용매, 촉매, 그룹을 포함하는 유기 화합물 생산용 시약 - SO 2 F), BF 3(촉매), 유기불소 화합물 등 수많은 불소 화합물이 널리 사용됩니다.
안전 예방 조치.불소는 독성이 있으며, 공기 중 최대 허용 농도는 약 2·10 -4 mg/l이고, 1시간 이하 노출 시 최대 허용 농도는 1.5·10 -3 mg/l입니다.
체내의 불소.불소는 동물과 식물 조직에 지속적으로 포함되어 있습니다. 미량 원소 무기 화합물의 형태로 주로 동물과 인간의 뼈에서 발견됩니다 - 100-300 mg/kg; 특히 치아에는 불소가 많이 들어있습니다. 해양동물의 뼈는 육지동물의 뼈에 비해 불소가 더 풍부합니다. 주로 식수를 통해 동물과 인간의 몸에 들어갑니다. 최적의 불소 함량은 1~1.5mg/l입니다. 불소가 부족하면 충치가 발생하고 섭취량이 증가하면 불소증이 발생합니다. 고농도의 불소 이온은 여러 가지 효소 반응을 억제하고 생물학적으로 중요한 요소를 결합하는 능력 때문에 위험합니다. (P, Ca, Mg 등)이 체내 균형을 깨뜨립니다. 유기 불소 유도체는 일부 식물(예: 남아프리카 Dichapetalum cymosum)에서만 발견됩니다. 주요한 것들은 다른 식물과 동물 모두에게 독성이 있는 플루오로아세트산의 유도체입니다. 불소 대사와 골격 조직, 특히 치아의 형성 사이에는 연관성이 확립되었습니다.
불소 중독은 화학 산업 근로자, 불소 함유 화합물 합성 및 인산염 비료 생산 과정에서 발생할 수 있습니다. 불소는 호흡기를 자극하고 피부 화상을 유발합니다. 급성 중독에서는 후두와 기관지 점막의 자극, 눈, 타액 분비 및 코피가 발생합니다. 심한 경우 - 폐부종, 중추 신경계 손상 및 기타; 만성적인 경우 - 결막염, 기관지염, 폐렴, 폐렴, 불소증. 습진 등의 피부 병변이 특징적입니다. 응급 처치: 물로 눈을 헹구고, 피부 화상의 경우 - 70% 알코올로 관개합니다. 흡입 중독의 경우 - 산소 흡입. 예방 : 안전 규정 준수, 특수 의류 착용, 정기 건강 검진, 식단에 칼슘과 비타민 포함.
1.3 염소
염소(lat. Chlorum), Cl, 멘델레예프 주기율표 VII족의 화학 원소, 원자 번호 17, 원자 질량 35.453; 할로겐 계열에 속합니다. 정상적인 조건(0°C, 0.1 Mn/m2 또는 1 kgf/cm2)에서는 날카로운 자극적인 냄새가 나는 황록색 가스입니다. 천연 염소는 35 Cl(75.77%)과 37 Cl(24.23%)의 두 가지 안정 동위원소로 구성됩니다. 질량수 31-47의 방사성 동위원소는 인위적으로 획득되었으며, 특히 반감기(TS)가 각각 0.31인 32, 33, 34, 36, 38, 39, 40입니다. 2.5; 1.56초; 3.1·105년; 37.3분, 55.5분, 1.4분 36Cl과 38Cl은 동위원소 추적자로 사용됩니다.
역사적 참고자료.염소는 1774년 K. Scheele에 의해 염산과 피로루사이트 MnO 2 를 반응시켜 처음으로 얻었습니다. 그러나 1810년 G. Davy는 염소가 원소임을 확인하고 이를 염소라고 명명했습니다(그리스 클로로 - 황록색에서 유래). 1813년에 J. L. Gay-Lussac은 이 원소에 염소라는 이름을 제안했습니다.
자연의 염소 분포.염소는 자연에서 화합물의 형태로만 존재합니다. 지각(클라크)의 평균 염소 함량은 1.7·10 -2%, 산성 화성암(화강암 등)에서는 2.4·10 -2, 염기성 및 초염기성 암석에서는 5·10 -3이다. 지각의 염소 역사에서 주요 역할은 물 이동에 의해 수행됩니다. Cl 이온의 형태로 세계 해양(1.93%), 지하 염수 및 염호에서 발견됩니다. 자체 미네랄(주로 천연 염화물)의 수는 97개이며, 주요 광물은 암염(암염)입니다. 칼륨 및 염화마그네슘 및 혼합 염화물의 대규모 퇴적물도 알려져 있습니다: 실비나이트 KCl, 실비나이트(Na,K)Cl, 카르날라이트 KCl MgCl 2 6H 2 O, 카이나이트 KCl MgSO 4 3H 2 O, 비스코파이트 MgCl 2 6H 2 O 역사에 지구의 경우, 화산 가스에 포함된 HCl을 지각 상부로 공급하는 것이 매우 중요했습니다.
염소의 물리적 특성.염소의 끓는점은 -34.05°C, 녹는점은 -101°C입니다. 정상적인 조건에서 염소 가스의 밀도는 3.214g/l입니다. 0°C의 포화 증기 12.21g/l; 끓는점 1.557 g/cm3의 액체 염소; - 102°C에서 고체 염소 1.9 g/cm 3 . 0°C에서 염소의 포화 증기압 0.369; 25°C에서 0.772; 100°C에서 3.814 Mn/m 2 또는 각각 3.69; 7.72; 38.14kgf/cm2. 융해열 90.3kJ/kg(21.5cal/g); 증발열 288 kJ/kg(68.8 cal/g); 일정한 압력에서 기체의 열용량은 0.48 kJ/(kg K)입니다. 염소의 임계상수: 온도 144°C, 압력 7.72 Mn/m2 (77.2 kgf/cm2), 밀도 573 g/l, 비체적 1.745·10 -3 l/g. 부분압 0.1 Mn/m2 또는 1 kgf/cm2에서 물에 대한 염소 용해도(g/l) 14.8(0°C), 5.8(30°C), 2.8(70°C); 300g/l NaCl 용액 1.42(30°C), 0.64(70°C). 9.6°C 미만에서는 다양한 조성의 Cl 2 ·nH 2 O(n = 6-8)의 염소 수화물이 수용액에서 형성됩니다. 이것은 온도가 증가함에 따라 염소와 물로 분해되는 노란색 입방체 결정입니다. 염소는 TiCl 4, SiCl 4, SnCl 4 및 일부 유기 용매(특히 헥산 C 6 H 14 및 사염화탄소 CCl 4)에 매우 잘 녹습니다. 염소 분자는 이원자(Cl 2)입니다. Cl 2 + 243 kJ = 2Cl의 열해리도는 1000 K에서 2.07·10 -4%, 2500 K에서는 0.909%이다.
염소의 화학적 성질. Cl 3s 2 Sp 5 원자의 외부 전자 구성. 이에 따라 화합물의 염소는 -1, +1, +3, +4, +5, +6 및 +7의 산화 상태를 나타냅니다. 원자의 공유결합 반경은 0.99 E, Cl의 이온 반경은 1.82 E, 염소 원자의 전자 친화도는 3.65 eV, 이온화 에너지는 12.97 eV입니다.
화학적으로 염소는 매우 활동적이며 거의 모든 금속(수분이 있거나 가열된 경우에만 일부) 및 비금속(탄소, 질소, 산소, 불활성 가스 제외)과 직접 결합하여 해당 염화물을 형성하고 다음과 반응합니다. 많은 화합물은 포화 탄화수소의 수소를 대체하고 불포화 화합물을 결합합니다. 염소는 화합물의 브롬과 요오드를 수소와 금속으로 대체합니다. 이러한 원소를 포함하는 염소 화합물 중에서 불소로 대체됩니다. 미량의 수분이 있는 알칼리 금속은 염소와 반응하여 점화됩니다. 대부분의 금속은 가열될 때만 건조 염소와 반응합니다. 강철은 일부 금속과 마찬가지로 저온의 건조염소 분위기에 대한 내성이 강하므로 건조염소용 장비 제조 및 저장시설에 사용됩니다. 인은 염소 대기에서 발화하여 PCl 3을 형성하고 추가 염소화 - PCl 5를 형성합니다. 황과 염소를 가열하면 S 2 Cl 2, SCl 2 및 기타 Sn Cl m이 생성됩니다. 비소, 안티몬, 비스무트, 스트론튬, 텔루륨은 염소와 활발하게 상호작용합니다. 염소와 수소의 혼합물은 염화수소를 형성하면서 무색 또는 황록색 불꽃으로 연소됩니다(이것은 연쇄 반응입니다).
염소-염소 불꽃의 최대 온도는 2200°C입니다. 5.8~88.5% H 2 를 함유한 염소와 수소의 혼합물은 폭발성이 있습니다.
산소와 함께 염소는 Cl 2 O, ClO 2, Cl 2 O 6, Cl 2 O 7, Cl 2 O 8뿐만 아니라 차아염소산염(차아염소산 염), 아염소산염, 염소산염 및 과염소산염과 같은 산화물을 형성합니다. 염소의 모든 산소 화합물은 쉽게 산화되는 물질과 폭발성 혼합물을 형성합니다. 산화염소는 약하게 안정적이며 자연적으로 폭발할 수 있습니다. 차아염소산염은 저장 중에 천천히 분해되고, 과염소산염은 개시제의 영향으로 폭발할 수 있습니다.
물 속의 염소는 가수분해되어 차아염소산과 염산을 형성합니다. Cl 2 + H 2 O = HClO + HCl. 알칼리 수용액을 추위에 염소화하면 차아염소산염과 염화물이 형성됩니다. 2NaOH + Cl 2 = NaClO + NaCl + H 2 O, 가열하면 염소산염이 형성됩니다. 건조 수산화칼슘을 염소화하면 표백제가 생성됩니다.
암모니아가 염소와 반응하면 삼염화질소가 생성됩니다. 유기 화합물을 염소화할 때 염소는 수소를 대체하거나 다중 결합을 추가하여 다양한 염소 함유 유기 화합물을 형성합니다.
염소는 다른 할로겐과 함께 할로겐간 화합물을 형성합니다. 불화물 ClF, ClF 3, ClF 3은 반응성이 매우 높습니다. 예를 들어, ClF3 대기에서는 유리솜이 자연적으로 발화됩니다. 알려진 염소와 산소 및 불소의 화합물은 염소 옥시불화물: ClO 3 F, ClO 2 F 3, ClOF, ClOF 3 및 과염소산 불소 FClO 4입니다.
염소 얻기.염소는 염산과 산화 망간(II) 또는 피로루사이트를 반응시켜 1785년부터 산업적으로 생산되기 시작했습니다. 1867년 영국의 화학자 G. Deacon은 촉매 존재 하에서 HCl을 대기 산소로 산화시켜 염소를 생산하는 방법을 개발했습니다. 19세기 후반과 20세기 초반부터 알칼리 금속 염화물 수용액을 전기분해하여 염소를 생산해왔습니다. 이러한 방법으로 전 세계 염소의 90~95%가 생산됩니다. 소량의 염소는 용융 염화물을 전기분해하여 마그네슘, 칼슘, 나트륨 및 리튬을 생산할 때 부산물로 얻어집니다. NaCl 수용액의 전기분해에는 두 가지 주요 방법이 사용됩니다. 1) 고체 음극과 다공성 필터 다이어프램이 있는 전해조에서; 2) 수은 음극이 있는 전해조에서. 두 가지 방법 모두 흑연 또는 산화물 티타늄-루테늄 양극에서 염소 가스가 방출됩니다. 첫 번째 방법은 음극에서 수소가 방출되어 NaOH와 NaCl의 용액이 형성되고, 이로부터 후속 공정을 통해 상업용 가성소다를 분리하는 방법이다. 두 번째 방법에 따르면 음극에서 나트륨 아말감이 형성되고, 별도의 장치에서 순수한 물로 분해되면 NaOH 용액, 수소 및 순수한 수은이 얻어지며 다시 생산에 들어갑니다. 두 방법 모두 염소 1톤당 1.125t의 NaOH를 생성합니다.
격막을 이용한 전기분해는 염소 생산을 조직화하는 데 더 적은 자본 투자가 필요하며 더 저렴한 NaOH를 생산합니다. 수은 음극법은 매우 순수한 NaOH를 생산하지만 수은의 손실로 인해 환경이 오염됩니다.
염소 사용.화학 산업의 중요한 분야 중 하나는 염소 산업입니다. 대부분의 염소는 생산 현장에서 염소 함유 화합물로 가공됩니다. 염소는 실린더, 배럴, 철도 탱크 또는 특수 장비를 갖춘 용기에 액체 형태로 저장 및 운송됩니다. 산업 국가의 대략적인 염소 소비량은 다음과 같습니다. 염소 함유 유기 화합물 생산의 경우 - 60-75%; 염소를 함유한 무기 화합물, -10-20%; 펄프 및 직물 표백용 - 5-15%; 위생 요구 및 물 염소 처리 - 총 생산량의 2-6%.
염소는 티타늄, 니오븀, 지르코늄 등을 추출하기 위해 특정 광석을 염소화하는 데에도 사용됩니다.
신체의 염소.염소는 식물과 동물 조직의 일정한 구성 요소인 생체 요소 중 하나입니다. 식물의 염소 함량(염생식물의 많은 염소)은 1000분의 1퍼센트에서 전체 퍼센트까지, 동물의 경우 10분의 1퍼센트와 100분의 1퍼센트에 이릅니다. 성인의 일일 염소 요구량(2~4g)은 식품으로 충당됩니다. 염소는 일반적으로 염화나트륨과 염화칼륨의 형태로 식품에 과잉 공급됩니다. 빵, 고기, 유제품에는 특히 염소가 풍부합니다. 동물의 몸에서 염소는 혈장, 림프, 뇌척수액 및 일부 조직의 주요 삼투압 활성 물질입니다. 물-소금 대사에 역할을 하여 조직의 수분 보유를 촉진합니다. 조직의 산-염기 균형 조절은 혈액과 다른 조직 사이의 염소 분포를 변경하여 다른 과정과 함께 수행됩니다. 염소는 식물의 에너지 대사에 관여하여 산화적 인산화와 광인산화를 모두 활성화합니다. 염소는 뿌리의 산소 흡수에 긍정적인 영향을 미칩니다. 염소는 분리된 엽록체에 의한 광합성 동안 산소 생산에 필요합니다. 대부분의 인공식물재배용 영양배지에는 염소가 포함되어 있지 않습니다. 매우 낮은 농도의 염소만으로도 식물 발달에 충분할 수 있습니다.
화학, 펄프 및 제지, 섬유, 제약 산업 및 기타 산업에서 염소 중독이 발생할 수 있습니다. 염소는 눈과 호흡기의 점막을 자극합니다. 1차 염증 변화에는 대개 2차 감염이 동반됩니다. 급성 중독은 거의 즉시 발생합니다. 중간 및 낮은 농도의 염소를 흡입하면 가슴의 답답함과 통증, 마른 기침, 빠른 호흡, 눈의 통증, 눈물, 혈액 내 백혈구 수치 증가, 기관지 폐렴, 독성 폐부종이 관찰됩니다. , 우울한 상태, 경련이 가능합니다. 가벼운 경우에는 3~7일 이내에 회복됩니다. 장기적인 결과로 상부 호흡기 카타르, 재발성 기관지염, 폐렴 등이 관찰됩니다. 폐결핵의 활성화 가능성. 소량의 염소를 장기간 흡입하면 유사하지만 천천히 진행되는 질병 형태가 관찰됩니다. 중독 예방: 생산 시설, 장비를 밀봉하고, 효과적인 환기, 필요한 경우 방독면을 사용합니다. 염소, 표백제 및 기타 염소 함유 화합물의 생산은 위험한 작업 조건의 생산으로 분류됩니다.
1.4 브롬
브롬(위도 Bromum), Mendeleev 주기율표 VII 족의 화학 원소 인 Br은 할로겐에 속합니다. 원자 번호 35, 원자 질량 79.904; 강한 불쾌한 냄새가 나는 적갈색 액체. 브롬은 1826년 프랑스 화학자 A. J. 발라드(A. J. Balard)가 지중해 염전의 염수를 연구하던 중 발견했습니다. 그리스어에서 유래된 이름. 브로모스 - 악취. 천연 브롬은 2개의 안정 동위원소인 79 Br(50.54%)과 81 Br(49.46%)로 구성됩니다. 인위적으로 얻은 방사성 동위원소 중에서 브롬은 가장 흥미로운 80Br이며, I. V. Kurchatov가 원자핵의 이성질체 현상을 발견한 예입니다.
자연에서의 브롬 분포.지각의 브롬 함량(질량 기준 1.6·10 -4%)은 10 15 -10 16 톤으로 추정됩니다. 브롬은 대부분 화성암뿐만 아니라 광범위한 할로겐화물에 분산된 상태로 발견됩니다. 브롬은 염소의 끊임없는 동반자입니다. 브롬화물 염(NaBr, KBr, MgBr 2)은 염화물 염(식용염에서 최대 0.03% Br, 칼륨염 - 실바이트 및 카르날라이트 - 최대 0.3% Br) 및 해수(0.065)의 침전물에서 발견됩니다. % Br), 염호 염수(최대 0.2% Br) 및 일반적으로 소금 및 석유 퇴적물과 관련된 지하 염수(최대 0.1% Br). 물에 대한 용해도가 좋기 때문에 브롬화물 염은 바다와 호수 수역의 잔류 염수에 축적됩니다. 브롬은 쉽게 용해되는 화합물의 형태로 이동하며 브롬산염 AgBr, 색전석 Ag(Cl, Br) 및 요오뎀볼라이트 Ag(Cl, Br, I)로 대표되는 고체 광물 형태를 거의 형성하지 않습니다. 미네랄의 형성은 건조한 사막 지역에서 형성되는 황화은 퇴적물의 산화 구역에서 발생합니다.
브롬의 물리적 특성.-7.2°C에서 액체 브롬이 응고되어 희미한 금속 광택을 지닌 적갈색 바늘 모양의 결정으로 변합니다. 브롬 증기는 황갈색이며 끓는점은 58.78°C입니다. 액체 브롬의 밀도(20°C에서)는 3.1g/cm 3 입니다. 브롬은 제한된 범위에서 물에 용해되지만 다른 할로겐보다 우수합니다(20°C에서 100g의 H 2 O에 3.58g의 브롬이 있음). 5.84°C 이하에서는 Br 2 8H 2 O의 적색 석류석 결정이 물에서 침전됩니다. 브롬은 특히 많은 유기 용매에 용해되며 수용액에서 브롬을 추출하는 데 사용됩니다. 고체, 액체 및 기체 상태의 브롬은 2원자 분자로 구성됩니다. 원자로의 눈에 띄는 해리는 약 800°C의 온도에서 시작됩니다. 빛의 영향으로 해리도 관찰됩니다.
브롬의 화학적 성질.브롬 원자의 외부 전자 구성은 4s 2 4p 5입니다. 화합물에서 브롬의 원자가는 다양하며, 산화 상태는 -1(브로마이드, 예를 들어 KBr), +1(하이포아브롬산염, NaBrO), +3(브롬산염, NaBrO 2), +5(브롬산염, KBrOz)입니다. ) 및 +7 (과브롬산염에서는 NaBrO 4). 화학적으로 브롬은 매우 활동적이어서 염소와 요오드 사이의 반응성에서 중요한 위치를 차지합니다. 브롬과 황, 셀레늄, 텔루르, 인, 비소 및 안티몬의 상호 작용은 강한 가열을 동반하며 때로는 불꽃이 나타나는 경우도 있습니다. 브롬은 또한 칼륨 및 알루미늄과 같은 일부 금속과 격렬하게 반응합니다. 그러나 많은 금속은 브롬에 불용성인 브롬화물 보호막이 표면에 형성되기 때문에 무수 브롬과 반응하기 어렵습니다. 금속 중에서 고온 및 습기 존재 하에서도 브롬의 작용에 가장 잘 견디는 것은 은, 납, 백금 및 탄탈륨입니다(금은 백금과 달리 브롬과 격렬하게 반응함). 브롬은 고온에서도 산소, 질소 및 탄소와 직접 결합하지 않습니다. 이러한 원소를 가진 브롬 화합물은 간접적으로 얻어집니다. 이들은 매우 취약한 산화물인 Br 2 O, Br O 2 및 Br 3 O 8입니다(후자는 예를 들어 80°C에서 브롬에 대한 오존의 작용으로 얻어집니다). 브롬은 할로겐과 직접 반응하여 BrF 3, BrF 5, BrCl, IBr 등을 형성합니다.
브롬은 강력한 산화제입니다. 따라서 수용액의 아황산염과 티오 황산염을 황산염으로, 아질산염을 질산염으로, 암모니아를 유리 질소로 산화시킵니다 (3Br 2 + 8NH 3 = N 2 + NH 4 Br). 브롬은 화합물에서 요오드를 대체하지만 그 자체는 염소와 불소로 대체됩니다. 유리 브롬은 산성 환경에서 강한 산화제(KMnO 4, K 2 Cr 2 O 7)의 영향을 받아 브롬화물 수용액에서도 방출됩니다. 물에 용해되면 브롬은 물과 부분적으로 반응하여(Br 2 + H 2 O = HBr + HBrO) 브롬화수소산 HBr과 불안정한 차아브롬산 HBrO를 형성합니다. 물에 브롬이 용해된 용액을 브롬수라고 합니다. 브롬이 추위에 알칼리 용액에 용해되면 브롬화물과 하이포아브롬산염(2NaOH + Br 2 = NaBr + NaBrO + H 2 O)이 형성되고, 높은 온도(약 100°C)에서는 브롬화물과 브롬산염(6NaOH + 3Br 2 = 5NaBr + NaBrO3 + 3H2O). 브롬과 유기 화합물의 반응 중에서 가장 일반적인 반응은 C=C 이중 결합에서의 첨가와 수소 치환(보통 촉매나 빛의 작용 하에서)입니다.
브롬 획득.브롬 생산을 위한 출발 물질은 해수, 호수 및 지하 염수와 브롬화물 이온 Br(해수 중 65g/m 3 ~ 3-4kg/m 3 이상) 형태의 브롬을 함유한 칼륨 생산액입니다. 칼륨 주류 생산에서). 브롬은 염소(2Br - + Cl 2 = Br 2 + 2Cl -)의 도움으로 분리되고 수증기 또는 공기와 함께 용액에서 증류됩니다. 스팀 스트리핑은 화강암, 세라믹 또는 브롬에 강한 기타 재료로 만들어진 기둥에서 수행됩니다. 가열된 염수는 위에서 컬럼으로 공급되고, 염소와 수증기는 아래에서 공급됩니다. 컬럼에서 나오는 브롬 증기는 세라믹 냉장고에서 응축됩니다. 다음으로, 브롬은 물에서 분리되고 증류를 통해 염소 불순물로부터 정제됩니다. 에어 스트리핑을 사용하면 브롬 함량이 낮은 염수를 사용하여 브롬을 얻을 수 있습니다. 증기 소비가 높기 때문에 증기로 브롬을 추출하는 것은 수익성이 없습니다. 브롬은 화학 흡수제를 사용하여 생성된 브롬-공기 혼합물에서 제거됩니다. 이를 위해 브롬화철(2FeBr 2 + Br 2 = 2FeBr 3) 용액이 사용되며, 이는 FeBr 3를 철분으로 환원하여 얻어지며 수산화나트륨 또는 탄산염 또는 기체 이산화황 용액도 다음과 반응합니다. 브롬화수소산 및 황산(Br 2 + SO 2 + 2H 2 O = 2HBr + H 2 SO 4)이 형성되는 수증기 존재 하의 브롬. 브롬은 염소(FeBr 3 및 HBr) 또는 산(5NaBr + NaBrO 3 + 3 H 2 SO 4 = 3Br 2 + 3Na 2 SO 4 + 3H 2 O)의 작용에 의해 생성된 중간체에서 분리됩니다. 필요한 경우 중간 생성물은 원소 브롬을 방출하지 않고 브롬 화합물로 가공됩니다.
공기 중 함량이 1mg/m3 이상인 브롬 증기를 흡입하면 기침, 콧물, 코피, 현기증, 두통이 발생합니다. 더 높은 농도에서는 질식, 기관지염, 때로는 사망에 이릅니다. 공기 중 브롬 증기의 최대 허용 농도는 2mg/m3입니다. 액체 브롬은 피부에 작용하여 치유가 잘 안되는 화상을 유발합니다. 브롬을 사용한 작업은 흄후드에서 수행해야 합니다. 브롬 증기에 중독된 경우 암모니아를 흡입하는 것이 좋습니다. 이를 위해 물이나 에틸 알코올에 고도로 희석된 암모니아 용액을 사용합니다. 브롬 증기 흡입으로 인한 인후통은 뜨거운 우유를 섭취하면 완화됩니다. 피부에 묻은 브롬은 다량의 물로 씻어내거나 강한 공기를 불어 날려버립니다. 탄 부위는 라놀린으로 윤활 처리됩니다.
브롬의 적용.브롬은 꽤 널리 사용됩니다. 이는 다양한 브롬화물 염과 유기 유도체 생산을 위한 출발 제품입니다. 에틸브로마이드와 디브로모에탄(폭발 저항을 높이기 위해 휘발유에 첨가되는 에틸 액체 성분)을 생산하는 데 다량의 브롬이 소비됩니다. 브롬 화합물은 사진, 다양한 염료 생산에 사용되며 메틸 브로마이드 및 기타 브롬 화합물은 살충제로 사용됩니다. 일부 유기 브롬 화합물은 효과적인 소화제 역할을 합니다. 브롬과 브롬수는 많은 물질을 결정하기 위한 화학 분석에 사용됩니다. 의학에서는 나트륨, 칼륨, 브롬화 암모늄뿐만 아니라 신경증, 히스테리, 과민성 증가, 불면증, 고혈압, 간질 및 무도병에 사용되는 유기 브롬 화합물도 사용됩니다.
체내의 브롬.브롬은 동물과 식물 조직의 지속적인 구성 요소입니다. 육상 식물은 원재료에 평균 7·10 -4%의 브롬을 함유하고 있으며, 동물은 ~1·10 -4%를 함유하고 있습니다. 브롬은 다양한 분비물(눈물, 타액, 땀, 우유, 담즙)에서 발견됩니다. 건강한 사람의 혈액 내 브롬 함량은 0.11~2.00mg%입니다. 방사성 브롬(82Br)을 사용하여 갑상선, 신장 수질 및 뇌하수체에 의한 선택적 흡수가 확립되었습니다. 동물과 인간의 몸에 도입된 브롬화물은 대뇌 피질의 억제 과정의 농도를 증가시키고 억제 과정의 과도한 긴장으로 고통받는 신경계의 상태를 정상화하는 데 도움을 줍니다. 동시에 갑상선에 남아 있는 브롬은 요오드와 경쟁 관계를 맺게 되는데, 이는 갑상선 활동 및 이와 관련하여 신진대사 상태에 영향을 미칩니다.
1.5 요오드
요오드(lat. Iodum), Mendeleev 주기율표 VII 족의 화학 원소 인 I는 할로겐에 속합니다 (오래된 이름 Iodine과 기호 J도 문헌에서 발견됩니다). 원자 번호 53, 원자 질량 126.9045; 금속광택을 지닌 흑회색의 결정. 천연 요오드는 질량수가 127인 하나의 안정 동위원소로 구성됩니다. 요오드는 1811년 프랑스 화학자 B. Courtois에 의해 발견되었습니다. 해초 재의 모 염수를 진한 황산으로 가열함으로써 그는 보라색 증기(따라서 요오드라는 이름 - 그리스 요오드, 요오드 - 보라색과 같은 색상, 보라색)가 방출되는 것을 관찰했으며, 이는 어둡고 반짝이는 판 모양으로 응축되었습니다. 크리스탈. 1813~1814년에 프랑스 화학자 J. L. Gay-Lussac과 영국 화학자 G. Davy가 요오드의 원소 특성을 증명했습니다.
자연의 요오드 분포.지각의 평균 요오드 함량은 4·10-5질량%이다. 요오드 화합물은 맨틀과 마그마 및 이들로부터 형성된 암석(화강암, 현무암 및 기타)에 흩어져 있습니다. 요오드의 깊은 미네랄은 알려져 있지 않습니다. 지각 내 요오드의 역사는 생물 및 생물학적 이동과 밀접한 관련이 있습니다. 생물권에서는 특히 해양 생물(조류, 해면 등)에 의해 농도가 증가하는 과정이 관찰됩니다. 8개의 초유전자 요오드 광물이 생물권에서 형성되는 것으로 알려져 있지만 매우 드뭅니다. 생물권의 주요 요오드 저장소는 세계 해양입니다(1리터에는 평균 5·10-5g의 요오드가 포함되어 있습니다). 바다에서 바닷물에 용해된 요오드 화합물이 대기로 유입되어 바람을 타고 대륙으로 운반됩니다. (바다에서 멀리 떨어져 있거나 산으로 인해 해풍이 차단된 지역은 요오드가 고갈되어 있습니다.) 요오드는 토양 및 해양 미사에 있는 유기물에 쉽게 흡수됩니다. 이러한 미사가 압축되고 퇴적암이 형성되면 탈착이 일어나고 일부 요오드 화합물이 지하수로 유입됩니다. 이는 특히 유전 지역의 특징인 요오드 추출에 사용되는 요오드-브롬 물이 형성되는 방식입니다(일부 지역에서는 이러한 물 1리터에 100mg 이상의 요오드가 포함되어 있음).
요오드의 물리적 특성.요오드 밀도는 4.94g/cm 3, 녹는점 113.5°C, 끓는점 184.35°C입니다. 액체 및 기체 요오드 분자는 두 개의 원자(I 2)로 구성됩니다. I 2 = 2I의 눈에 띄는 해리는 700°C 이상과 빛의 영향 하에서 관찰됩니다. 이미 상온에서 요오드는 증발하여 날카로운 냄새가 나는 보라색 증기를 형성합니다. 약간 가열하면 요오드가 승화하여 반짝이는 얇은 판 형태로 침전됩니다. 이 과정은 실험실과 산업에서 요오드를 정화하는 역할을 합니다. 요오드는 물에 잘 녹지 않으며(25°C에서 0.33g/l), 이황화탄소와 유기 용매(벤젠, 알코올 등)뿐만 아니라 요오드화물 수용액에도 잘 녹습니다.
요오드의 화학적 성질.요오드 원자의 외부 전자 구성은 5s 2 5p 5입니다. 이에 따라 요오드는 화합물에서 -1(HI, KI), +1(HIO, KIO), +3(ICl 3), +5(HIO 3, KIO)에서 다양한 원자가(산화 상태)를 나타냅니다. 3 ) 및 +7(HIO 4, KIO 4). 화학적으로 요오드는 염소나 브롬보다 그 정도는 적지만 꽤 활성이 높습니다. 요오드는 약간 가열되면 금속과 격렬하게 반응하여 요오드화물(Hg + I 2 = HgI 2)을 형성합니다. 요오드는 완전히 가열되지 않은 경우에만 수소와 반응하여 요오드화수소를 형성합니다. 요오드는 탄소, 질소, 산소와 직접 결합하지 않습니다. 원소 요오드는 염소나 브롬보다 덜 강력한 산화제입니다. 황화수소 H 2 S, 티오황산나트륨 Na 2 S 2 O 3 및 기타 환원제는 이를 I - (I 2 + H 2 S = S + 2HI)로 감소시킵니다. 수용액의 염소 및 기타 강력한 산화제는 이를 IO 3 - (5Cl 2 + I 2 + 6H 2 O = 2HIO 3 H + 10HCl)로 변환합니다. 물에 용해되면 요오드는 부분적으로 반응합니다 (I 2 + H 2 O = HI + HIO). 뜨거운 알칼리 수용액에서는 요오드화물과 요오드산염이 형성됩니다(3I 2 + 6NaOH = 5NaI + NaIO 3 + 3H 2 O). 요오드는 전분에 흡착되면 진한 파란색으로 변합니다. 이는 요오드 검출을 위한 요오드 측정 및 정성 분석에 사용됩니다.
요오드 증기는 유독하며 점막을 자극합니다. 요오드는 피부를 소작하고 소독하는 효과가 있습니다. 요오드 얼룩은 소다 또는 티오황산나트륨 용액으로 씻어냅니다.
요오드 얻기.요오드 산업 생산의 원료는 석유 시추수입니다. 해초, 요오드산 나트륨 형태로 최대 0.4%의 요오드를 함유한 칠레산 질산나트륨 모액. 유수(보통 요오드 형태의 요오드 20-40 mg/l 함유)에서 요오드를 추출하려면 먼저 염소(2 NaI + Cl 2 = 2NaCl + I 2) 또는 아질산(2NaI + 2NaNO 2 + 2H 2 SO 4 = 2Na 2 SO 4 + 2NO + I 2 + 2H 2 O). 방출된 요오드는 활성탄에 흡착되거나 공기와 함께 배출됩니다. 석탄에 흡착된 요오드는 가성 알칼리 또는 아황산나트륨(I 2 + Na 2 SO 3 + H 2 O = Na 2 SO 4 + 2HI)으로 처리됩니다. 유리 요오드는 염소 또는 황산과 산화제(예: 중크롬산칼륨(K 2 Cr 2 O 7 + 7H 2 SO 4 + 6NaI = K 2 SO 4 + 3Na 2 SO 4))의 작용에 의해 반응 생성물로부터 분리됩니다. + Cr 2 (SO 4)S + 3I 2). 공기와 함께 불어내면 요오드는 황산화물(IV)과 수증기(2H 2 O + SO 2 + I 2 = H 2 SO 4 + 2HI)의 혼합물에 의해 흡수된 후 요오드는 염소(2HI + Cl)로 대체됩니다. 2 = 2HCl + I 2). 조결정성 요오드는 승화에 의해 정제됩니다.
요오드의 적용.요오드와 그 화합물은 주로 의학 및 분석 화학뿐만 아니라 유기 합성 및 사진에도 사용됩니다.
체내 요오드.요오드는 동물과 인간에게 필수적인 미량원소입니다. 타이가-삼림 비체르노젬, 건조한 대초원, 사막 및 산악 생지화학적 지역의 토양과 식물에서 요오드는 부족한 양으로 함유되어 있거나 다른 미량원소(Co, Mn, Cu)와 균형을 이루지 않습니다. 이는 이 지역의 풍토성 갑상선종의 확산과 관련이 있습니다. 토양의 평균 요오드 함량은 약 3·10 -4%이고 식물의 경우 약 2·10 -5%입니다. 지표 식수에는 요오드가 거의 없습니다(10 -7 ~ 10 -9%). 해안 지역에서는 공기 1m 3당 요오드의 양이 50mcg에 도달할 수 있고, 대륙 및 산악 지역에서는 1 또는 심지어 0.2mcg입니다.
식물의 요오드 흡수는 토양 내 요오드 화합물의 함량과 식물의 종류에 따라 달라집니다. 예를 들어 해초(fucus, 다시마, phyllophora)와 같은 일부 유기체(소위 요오드 농축기)는 최대 1%의 요오드를 축적하고 일부 스폰지는 최대 8.5%(골격 물질 스펀지에서)를 축적합니다. 요오드를 농축한 조류는 산업 생산에 사용됩니다. 요오드는 음식, 물, 공기와 함께 동물의 몸에 들어갑니다. 요오드의 주요 공급원은 식물성 제품과 사료입니다. 요오드 흡수는 소장의 앞쪽 부분에서 발생합니다. 인체는 근육에 약 10~25mg, 갑상선에 6~15mg을 포함하여 20~50mg의 요오드를 축적합니다. 방사성 요오드(131 I 및 125 I)를 사용하여 갑상선에서 요오드는 상피 세포의 미토콘드리아에 축적되고 그 안에 형성된 디요오드 및 모노요오드티로신의 일부이며 호르몬 테트라요오드티로닌(티록신)으로 응축된다는 것이 나타났습니다. 요오드는 주로 신장(최대 70-80%), 유선, 타액선, 땀샘을 통해 부분적으로 담즙과 함께 신체에서 배설됩니다.
생지화학적 지역에 따라 일일 식단의 요오드 함량은 다양합니다(사람의 경우 20~240mcg, 양의 경우 20~400mcg). 동물의 요오드 필요량은 동물의 생리적 상태, 계절, 온도, 환경의 요오드 함량에 대한 신체의 적응 정도에 따라 달라집니다. 인간과 동물의 일일 요오드 필요량은 체중 1kg당 약 3mcg입니다(임신 중 증가, 성장 증가 및 냉각). 요오드를 체내에 도입하면 기초 대사가 증가하고 산화 과정이 강화되며 근육이 탄탄해지고 성기능이 자극됩니다.
음식과 물에서 요오드 결핍이 더 많거나 적기 때문에 일반적으로 소금 1톤당 요오드화 칼륨 10-25g을 함유하는 식염의 요오드화가 사용됩니다. 요오드가 함유된 비료를 사용하면 작물의 요오드 함량을 두 배 또는 세 배로 늘릴 수 있습니다.
의학에서의 요오드.요오드를 함유한 제제에는 항균 및 항진균 특성이 있으며 항염증 및 산만 효과도 있습니다. 상처를 소독하고 수술 현장을 준비하기 위해 외부적으로 사용됩니다. 경구 복용 시 요오드 제제는 신진대사에 영향을 미치고 갑상선 기능을 향상시킵니다. 소량의 요오드(마이크로요오드)는 갑상선 기능을 억제하여 뇌하수체 전엽에서 갑상선 자극 호르몬의 형성에 영향을 미칩니다. 요오드는 단백질과 지방(지질) 대사에 영향을 미치기 때문에 혈액 내 콜레스테롤을 감소시켜 죽상경화증 치료에 적용됩니다. 또한 혈액의 섬유소 용해 활성을 증가시킵니다. 진단 목적으로 요오드를 함유한 방사선 불투과제가 사용됩니다.
요오드 제제를 장기간 사용하고 이에 대한 민감도가 증가하면 콧물, 두드러기, Quincke 부종, 타액 분비 및 눈물 흘림, 여드름과 같은 발진 (요오드 피부증) 등 요오드 중독이 나타날 수 있습니다. 폐결핵의 경우 요오드 제제를 복용해서는 안됩니다. , 임신, 신장 질환, 만성 농피증, 출혈성 체질, 두드러기.
요오드는 방사성이다.요오드의 인공 방사성 동위원소 - 125 I, 131 I, 132 I 및 기타는 생물학, 특히 의학에서 갑상선의 기능 상태를 결정하고 여러 질병을 치료하기 위해 널리 사용됩니다. 진단에 방사성 요오드를 사용하는 것은 요오드가 갑상선에 선택적으로 축적되는 능력과 관련이 있습니다. 의약 목적으로 사용하는 것은 요오드 방사성 동위원소의 베타 방사선이 샘의 분비 세포를 파괴하는 능력에 기초합니다. 환경이 핵분열 생성물로 오염되면 요오드의 방사성 동위원소가 생물학적 주기에 빠르게 포함되어 궁극적으로 우유에 들어가고 결과적으로 인체에 들어갑니다. 갑상선이 성인보다 10배 작고 방사선 민감도가 더 높은 어린이의 몸에 침투하는 것은 특히 위험합니다. 갑상선에 방사성 요오드 동위원소의 침착을 줄이기 위해 안정 요오드 제제(1회 투여량당 100-200mg)를 사용하는 것이 좋습니다. 방사성 요오드는 위장관에서 신속하고 완전하게 흡수되어 선택적으로 갑상선에 침착됩니다. 흡수는 분비샘의 기능적 상태에 따라 달라집니다. 상대적으로 높은 농도의 요오드 방사성 동위원소는 타액선, 유선, 위장관 점막에서도 발견됩니다. 갑상선에 흡수되지 않는 방사성 요오드는 거의 완전하고 상대적으로 빠르게 소변으로 배설됩니다.
유사한 문서
주기율표 D.I의 VII 족의 주요 하위 그룹을 구성하는 할로겐의 개념 및 기본 특성 연구 - 화학 원소 (불소, 염소, 브롬, 요오드 및 아스타틴). 멘델레예프. 할로겐이 인체에 미치는 긍정적이고 부정적인 영향.
프레젠테이션, 2011년 10월 20일에 추가됨
화학 원소 주기율표의 발견 및 위치의 역사 D.I. 멘델레예프 할로겐: 불소, 염소, 브롬, 요오드 및 아스타틴. 요소의 화학적 및 물리적 특성, 그 응용. 원소의 보급과 단순 물질의 생산.
프레젠테이션, 2014년 3월 13일에 추가됨
할로겐과 관련된 화학 원소: 불소, 염소, 브롬, 요오드 및 아스타틴. 화학적 특성, 원소의 원자 번호, 물리적 특성, 이온화 에너지 및 전기 음성도. 할로겐의 산화 상태, 해리 에너지.
프레젠테이션, 2013년 12월 16일에 추가됨
할로겐의 개념과 실제적 중요성, 물리적, 화학적 특성, 독특한 특징. 할로겐 생산의 특성 및 방법: 요오드, 브롬, 염소, 불소, 아스타틴. 이러한 할로겐의 특징적인 반응, 사용 영역.
프레젠테이션, 2011년 3월 11일에 추가됨
주기율표 IV족 화학 원소의 일반적인 특성, 자연에서의 발생 및 기타 비금속과의 화합물. 게르마늄, 주석, 납의 준비. 티타늄 하위군 금속의 물리화학적 특성. 지르코늄의 적용 분야.
프레젠테이션, 2014년 4월 23일에 추가됨
할로겐은 멘델레예프 주기율표 VII족의 주요 하위 그룹에 속하는 화학 원소입니다. 할로겐에는 불소, 염소, 브롬, 요오드 및 아스타틴이 포함됩니다. 모든 할로겐은 에너지 산화제이므로 자연에서 화합물 형태로만 발견됩니다.
초록, 2009년 3월 20일에 추가됨
염소는 원자 번호 17을 갖는 세 번째 주기의 화학 원소 주기율표의 17번째 원소입니다. 할로겐 그룹의 일부인 화학적 활성 비금속입니다. 염소의 물리적 특성, 금속 및 비금속과의 상호 작용, 산화 반응.
프레젠테이션, 2011년 12월 26일에 추가됨
질소 하위 그룹의 요소 특성, 원자의 구조 및 특성. 주기율표에서 원소를 위에서 아래로 이동할 때 금속 특성이 증가합니다. 자연에 존재하는 질소, 인, 비소, 안티몬, 비스무트의 분포와 그 응용.
초록, 2009년 6월 15일에 추가됨
할로겐의 물리적, 화학적 특성과 멘델레예프의 원소 주기율표에서의 위치. 염소, 브롬, 요오드, 불소의 주요 공급원과 생물학적 중요성. 자연에서 할로겐을 찾아 생산 및 산업 용도로 사용합니다.
프레젠테이션, 2014년 12월 1일에 추가됨
금속의 일반적인 특성. 정의, 구조. 일반적인 물리적 특성. 금속을 얻는 방법. 금속의 화학적 성질. 금속 합금. 주요 하위 그룹 요소의 특성. 전이금속의 특성.
할로겐 하위 그룹
3번 강의
강의개요
1. 하위 그룹의 일반적인 특성
2. 자연 속에 있는 것. 불소 생산의 역사
3. 불소를 얻는 방법
4. 불소의 물리화학적 성질
5. 불소 화합물 – 불화물
6. 불화수소의 물리화학적 성질
7. 불소산소 화합물
8. 불소 및 그 화합물의 응용
9. 자연 속에 있는 것. 염소 생산의 역사
10. 불소의 물리화학적 성질
11. 염소 화합물 - 염화물. 할로겐화수소의 비교 특성
12. 염소의 산소 화합물
13. 염소 및 그 화합물의 사용. 염소의 생물학적 역할.
14. 자연 속에 있는 것. 브롬, 요오드 획득 이력
15. 브롬과 요오드의 물리화학적 성질
16. 브롬과 요오드의 화합물
17. 브롬과 요오드의 사용
주요 하위 그룹의 VII족(17) 원소에는 불소 F, 염소 Cl, 브롬 Br, 요오드 I, 아스타틴 At가 포함됩니다.
바닥 상태에서 할로겐 원자는 외부 에너지 준위(...ns 2 np 5)의 전자 구성을 갖습니다. 여기서 n은 주요 양자 수(주기 수)입니다. 다음 산화 상태는 할로겐 원자의 특징입니다. 불소의 경우 – (-1, 0); 염소의 경우 - (-1, 0, +1, +3, (+4), +5, (+6), +7); 브롬 – (-1, 0, +1, +3, (+4), +5, +7); 아스타틴의 경우 - (-1, 0, +5).
테이블에 1은 주요 하위 그룹의 그룹 VII(17)의 주요 속성을 나타냅니다.
| 재산 | 에프 | Cl | 브르 | 나 | ~에 |
| 핵심 담당 | |||||
| 바닥 상태의 외부 에너지 준위의 전자 구성 | ...2초 2 2p 5 | ...3초 2 3p 5 | ...4초 2 4p 5 | ...5초 2 5p 5 | ...6초 2 6p 5 |
| 궤도 반경, 오후 | – | ||||
| 이온화 에너지, eV | 17,46 | 13,01 | 11,82 | 10,30 | 9,2 |
| 전자 친화력 에너지, , eV | 3,45 | 3,61 | 3,37 | 3,08 | – |
| 전기 음성도: Allred-Rochow에 따르면 Pauling에 따르면 | 4,00 4,10 | 3,20 2,83 | 3,00 2,48 | 2,70 2,21 | 2,20 1,96 |
| 녹는점, ºС | –220,6 | –100,9 | –7,2 | +113,5 | +298 |
| 끓는점, ºС | –187,7 | –34,2 | +58,8 | +184,5 | +411 |
| 커뮤니케이션 역학, 오후 | – | ||||
| E 결합, kJ/mol | – |
주요 하위 그룹인 VII 그룹에서는 위에서 아래로 핵의 유효 전하가 증가하고 궤도 반경도 증가하며 이온화 에너지가 감소하고 원자의 환원 특성이 증가합니다. 할로겐 원자는 높은 이온화 에너지를 특징으로 하므로 환원 특성이 거의 없습니다.
주요 하위 그룹인 VII 그룹에서는 위에서 아래로 유효 핵 전하가 증가하고 궤도 반경이 증가하며 전자 친화력 에너지가 감소하고 원자의 산화 특성이 감소합니다.
불소 원자에는 자유 d-오비탈이 없으며, 불소 원자의 원자가 전자(... 2s 2 2p 5)는 핵의 작용으로부터 약하게 보호됩니다. 이는 불소 원자의 작은 반경과 높은 값을 설명합니다. 이온화 에너지와 전기 음성도. 불소 원자의 전자 친화력 에너지는 염소 원자의 전자 친화력 에너지보다 낮습니다. 이는 불소 원자의 반경이 작고 원자에 전자가 추가될 때 전자간 반발력이 강하기 때문입니다.
주 하위 그룹인 VII 그룹에서는 위에서 아래로 이온화 에너지가 감소하고 전자 친화력 에너지가 감소하며 전기 음성도가 감소합니다.
기체, 액체 및 고체 상태에서 할로겐 분자는 이원자 G 2입니다. 이러한 물질은 분자 결정 격자를 갖고 있어 끓는점과 녹는점이 낮습니다.
주요 하위 그룹인 그룹 VII에서는 녹는점과 끓는점의 온도가 위에서 아래로 증가합니다. 분자 결정 격자를 가진 물질의 경우 녹는점과 끓는점은 분자간 상호 작용 에너지에 따라 달라집니다. 할로겐 분자는 비극성이므로 분자간 상호 작용의 에너지는 극성 값에만 의존합니다. 분극성은 화학 결합 길이와 총 전자 수의 증가로 인해 F 2 에서 Cl 2 로 증가합니다.
자유 형태에서 모든 할로겐은 색상이 지정됩니다. F 2는 연한 녹색 가스이고 Cl 2는 황록색 가스입니다. Br 2 – 적갈색 액체; I 2 – 회색-보라색 고체; ~에서 – 금속 광택이 나는 회색질.
9F 1초 2 2초 2 2p 5
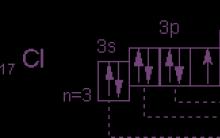
17 Cl 3s 2 3p 5
35BR 3d 10 4s 2 4p 5
53 나는 4d 10 5s 2 5p 5
85 4f 14 5d 10 6s 2 6p 5
VII 족의 주요 하위 그룹의 5개 원소는 "소금 생산"을 의미하는 "할로겐"(Hal)이라는 공통 그룹 이름을 갖습니다.
할로겐의 하위 그룹에는 불소, 염소, 브롬, 요오드 및 아스타틴이 포함됩니다(아스타틴은 방사성 원소이며 거의 연구되지 않음). 이들은 D.I 주기율표 그룹의 p-요소입니다. 멘델레예프. 외부 에너지 준위에서 원자는 7개의 전자(ns 2 np 5)를 갖습니다. 이것은 속성의 공통성을 설명합니다.
할로겐 하위 그룹 요소의 특성
그들은 각각 하나의 전자를 쉽게 추가하여 -1의 산화 상태를 나타냅니다. 할로겐은 수소 및 금속과의 화합물에서 이 정도의 산화를 갖습니다.
그러나 할로겐 원자는 불소 외에 +1, +3, +5, +7의 양성 산화 상태를 나타낼 수도 있습니다. 가능한 산화 상태 값은 전자 구조로 설명되며, 불소 원자의 경우 다이어그램으로 표시할 수 있습니다.
전기 음성도가 가장 높은 원소인 불소는 2p 하위 준위당 전자 하나만 받아들일 수 있습니다. 짝을 이루지 않은 전자가 하나 있으므로 불소는 1가일 수 있으며 산화 상태는 항상 -1입니다.
염소 원자의 전자 구조는 다이어그램으로 표현됩니다.

염소 원자는 3p 하위 준위에 하나의 짝을 이루지 않은 전자를 가지며 염소의 정상(비활성) 상태는 1가입니다. 그러나 염소는 세 번째 주기에 있기 때문에 10개의 전자를 수용할 수 있는 세 번째 하위 준위의 궤도가 5개 더 있습니다.
염소 원자의 여기 상태에서 전자는 3p 및 3s 하위 준위에서 3d 하위 준위로 이동합니다(다이어그램에서 화살표로 표시). 동일한 궤도에 위치한 전자의 분리(쌍)는 원자가를 2단위만큼 증가시킵니다. 분명히 염소와 그 유사체(불소 제외)는 홀수 가변 원자가 1, 3, 5, 7과 이에 상응하는 양성 산화 상태만 나타낼 수 있습니다. 불소에는 자유 궤도가 없습니다. 이는 화학 반응 중에 원자에서 쌍을 이루는 전자가 분리되지 않음을 의미합니다. 따라서 할로겐의 성질을 고려할 때 불소와 화합물의 특성을 항상 고려할 필요가 있다.
할로겐의 수소 화합물 수용액은 산입니다: HF - 불산(불소), HCl - 염산(염산), HBr - 브롬화수소, HI - 요오드화수소.
외부 전자층의 동일한 구조(ns 2 np 5)는 요소의 큰 유사성을 결정합니다.
단순 물질 - 비금속 F 2 (가스), Cl 2 (가스), Br 2 (l), l 2 (고체).
공유 결합을 형성할 때 할로겐은 B = I을 나타내는 비여기 원자에서 사용 가능한 하나의 짝을 이루지 않은 p-전자를 가장 자주 사용합니다.
CI, Br, I 원자의 원자가 상태.
전기음성도가 더 높은 원소의 원자와 결합을 형성함으로써 염소, 브롬 및 요오드 원자는 기저 원자가 상태에서 들뜬 상태로 전환될 수 있으며, 이는 전자가 d-하위 준위의 빈 궤도로 전환되는 것을 동반합니다. 이 경우 짝을 이루지 않은 전자의 수가 증가하고 그 결과 CI, Br, I 원자가 더 많은 수의 공유 결합을 형성할 수 있습니다.
F와 다른 할로겐의 차이점
F 원자에서 원자가 전자는 s- 및 p-하위 준위만 갖는 두 번째 에너지 준위에 있습니다. 이는 F 원자가 여기 상태로 전이할 가능성을 배제하므로 모든 화합물의 불소는 I와 동일한 상수 B를 나타냅니다. 또한 불소는 전기 음성도가 가장 높은 원소이므로 결과적으로 상수 c도 갖습니다. 영형. -1.
가장 중요한 할로겐 화합물
I. 할로겐화수소 HHal.
II 금속 할로겐화물(할로겐화수소산의 염)은 가장 많고 안정적인 할로겐 화합물입니다.
III. 유기할로겐 화합물
IV. 산소 함유 물질:
6개의 산화물이 존재하는 것으로 간주될 수 있는 불안정한 산화물(Cl 2 O, ClO 2, Cl 2 O 7, Br 2 O, BrO 2, I 2 O 5)
불안정한 옥소산(산 중 3개만이 개별 물질로 분리됨)(HClO 4, HlO 3, HlO 4);
옥소산의 염, 주로 아염소산염, 염소산염 및 과염소산염.
주기율표의 VII족에 포함된 원소는 주 하위 그룹인 할로겐 하위 그룹과 보조 하위 그룹인 망간 하위 그룹의 두 하위 그룹으로 나뉩니다. 수소는 원자가 외부 원자가 준위에 단일 전자를 갖고 있으므로 그룹 I에 배치되어야 하지만 동일한 그룹에 배치됩니다. 그러나 수소는 주요 하위 그룹의 원소인 알칼리 금속과 2차 하위 그룹의 원소인 구리, 은 및 금과 공통점이 거의 없습니다. 동시에 할로겐과 마찬가지로 활성 금속과 반응하여 전자를 추가하고 할로겐화물과 유사한 수소화물을 형성합니다.
할로겐의 하위 그룹에는 불소, 염소, 브롬, 요오드 및 아스타틴이 포함됩니다. 처음 네 가지 원소는 자연에서 발견되고 마지막 원소는 인공적으로 얻어지므로 다른 할로겐에 비해 연구가 훨씬 적습니다. 할로겐이라는 단어는 소금을 형성한다는 의미입니다. 하위 그룹의 요소는 많은 금속과 쉽게 반응하여 염을 형성하기 때문에 이 이름을 받았습니다.
모든 할로겐은 외부 전자 껍질의 구조가 s 2 p 5입니다. 따라서 그들은 쉽게 전자를 받아들여 안정적인 희가스 전자 껍질(s 2 p 6)을 형성합니다. 불소는 하위 그룹에서 원자 반경이 가장 작습니다. 나머지는 F 계열에서 증가합니다.
모든 할로겐 중에서 주기 II에 속하는 불소만이 채워지지 않은 d 수준을 갖지 않습니다. 이러한 이유로 짝을 이루지 않은 전자를 1개 이상 가질 수 없으며 -1의 원자가만 나타냅니다. 다른 할로겐 원자에서는 d 수준이 채워지지 않아 서로 다른 수의 짝을 이루지 않은 전자를 가질 수 있고 산소에서 관찰되는 원자가 -1, +1, +3, +5 및 +7을 나타낼 수 있습니다. 염소, 브롬, 요오드의 화합물.
망간 하위 그룹에는 망간, 테크네튬 및 레늄이 포함됩니다. 할로겐과 달리 망간 하위 그룹의 원소는 외부 전자 수준에 전자가 2개만 있으므로 전자를 부착하는 능력을 나타내지 않아 음으로 하전된 이온을 형성합니다.
망간은 자연에 풍부하고 산업에서 널리 사용됩니다.
테크네튬은 방사성이므로 자연에서는 발견되지 않지만 인위적으로 획득되었습니다(처음 E. Segre 및 C. Perrier, 1937). 이 원소는 우라늄의 방사성 붕괴로 인해 형성됩니다. 레늄은 미량원소 중 하나입니다. 독립적인 광물을 형성하지는 않지만 일부 광물, 특히 몰리브덴의 동반자로 발견됩니다. 이는 1925년 V.와 I. Noddak에 의해 발견되었습니다. 레늄을 소량 첨가한 합금은 내부식성이 향상되었습니다. 합금에 레늄을 첨가하면 기계적 강도가 증가합니다. 레늄의 이러한 특성으로 인해 귀금속 이리듐 대신 사용할 수 있습니다. 백금-백금-레늄 열전대는 백금-백금-이리듐 열전대보다 더 잘 작동하지만 휘발성 화합물 Re 2 O 7이 형성되기 때문에 매우 높은 온도에서는 사용할 수 없습니다.
65. 수소
수소는 영국의 물리학자 G. Cavendish에 의해 1766년에 발견되었습니다.
자연 속에 있는 것.지각, 즉 클라크의 수소 함량은 0.15%입니다. 이 요소는 지구 표면의 거의 3/4을 차지하는 많은 미네랄, 모든 유기 화합물 및 물의 일부입니다. 자유 상태에서 수소는 상층 대기와 일부 천연 가연성 가스에서 소량으로 발견됩니다.
물리적 특성.정상적인 조건에서 수소는 무색, 무취의 기체입니다. 수소는 모든 원소 중에서 가장 가볍습니다. 공기보다 14.5배 가벼우며 물에 약간 용해됩니다(상온에서 2부피의 수소가 100부피의 물에 용해됩니다). 253 C의 온도와 대기압에서 수소는 액체 상태로 변하고 259 C에서 고체로 변합니다. 분자량이 낮기 때문에 다공성 칸막이와 가열된 금속 칸막이를 통해 쉽게 확산(통과)됩니다. 이것이 바로 수소를 채우고 매우 조심스럽게 묶은 고무공이 잠시 후에 수축되는 이유입니다. 높은 온도에서 수소는 많은 금속(니켈, 백금, 팔라듐)에 잘 용해됩니다.
자연에서 수소는 세 가지 동위원소의 형태로 존재합니다. 프로튬(질량수 1), 중수소(질량수 2), 삼중수소(질량수 3). 천연 수소의 99.98%는 프로튬입니다.
화학적 특성.수소 원자는 하나의 전자만 갖고 있으므로 화합물을 형성할 때 하나의 공통 전자쌍을 형성하거나 다른 전자를 추가하여 희가스 헬륨처럼 2전자 외부 껍질을 형성하는 등 쉽게 전자를 방출할 수 있습니다.
핵의 전하가 작기 때문에 수소 원자는 상대적으로 전자를 약하게 끌어당기고 다른 원소가 쉽게 전자를 포기할 경우에만 전자를 붙일 수 있습니다. 이러한 원소는 알칼리 및 알칼리 토금속이며, 수소 대기에서 가열하면 염과 같은 화합물(수소화물)을 형성합니다.
2 K+ H 2 = 2 KN (수소화칼륨)
Ca + H 2 = CaH 2 (수소화칼슘)
수소는 양성 산화 상태를 나타내는 화합물의 특징입니다. 그것은 많은 비금속과 상호 작용합니다. 비금속의 활성에 따라 반응이 다른 속도로 진행될 수 있습니다. 따라서 수소는 항상 불소와 폭발적으로 상호작용합니다.
F 2 + H 2 = 2 HF(불화수소)
염소는 훨씬 더 조용하게 수소와 상호 작용합니다. 어둠 속에서 가열하지 않으면 반응이 매우 천천히 진행되고 빛에서는 훨씬 빠르게 진행되며 개시제 (스파크, 가열)가 있으면 즉시 폭발합니다. 따라서 염소와 수소의 혼합물은 폭발성이 있으므로 취급 시 극도의 주의가 필요합니다. 수소는 염소 분위기에서 잘 연소됩니다. 모든 경우에 수소와 염소의 반응은 다음 방정식에 따라 진행됩니다.
H 2 + C1 2 = 2 HC1(염화수소)
수소는 브롬 및 요오드와 매우 느리게 반응합니다.
수소는 염소와 마찬가지로 산소와도 활발하게 반응합니다.
2H 2 + O 2 = 2H 2 O
수소와 산소의 혼합물도 폭발성이 있으며 개시제가 있으면 폭발합니다.
수소는 고온 또는 고온에서 다른 비금속과 반응합니다. 온도와 압력. 예를 들어, 수소는 가열될 때만 황과 반응하고, 열과 고압에서는 질소와 반응합니다.
H 2 + S = H 2 S(황화수소)
3 H 2 + N 2 = 2 NH 3 (암모니아)
수소는 많은 금속과 비금속에서 산소나 할로겐을 제거할 수 있습니다. 이 경우 환원제 역할을 합니다.
CuO + H 2 = Cu + H 2 O
CuCl 2 + H 2 = Cu + 2 HC1
이러한 반응은 야금학에서 자유 금속을 생성하는 데 사용됩니다. 일반적으로 고온에서 발생합니다. 금속의 활성이 높을수록 이를 감소시키는 데 필요한 온도가 높아집니다.
원자수소는 분자수소보다 더 활동적이므로 수소와 원자수소의 특징적인 모든 반응은 더 활발하게 진행됩니다. 분자 수소가 가열될 때만 염에서 금속을 환원한다면 원자 수소는 수용액에서도 염에서 많은 금속을 환원할 수 있습니다.
원자로부터 수소 분자가 형성되면 다량의 열이 방출됩니다.
H + H = H2 + 435kJ
원자 수소를 포함하는 가스의 전류를 고체에 흐르게 하면 그로 인해 발생합니다. 원자에서 수소 분자가 형성되어 열이 방출되면 신체 표면 온도가 4000 °C까지 증가합니다. 이 반응은 용접에 사용됩니다.
영수증.실험실 조건에서 수소가 얻어집니다.
1) 금속 (대부분 아연)과 염산의 상호 작용 또는
희석된 유황. 산:
Zn + 2 HCl = ZnС1 2 + H 2
이온 형태의 방정식은 다음과 같습니다.
Zn + 2 N = Zn 2 + N 2
반응은 Kipp 장치에서 수행됩니다. (그림 40). 과립화된 아연은 중간 볼에 적재되고 탭이 닫힌 상태에서 상부 볼은 산성 용액으로 채워집니다. 작동 장치에서 상부 볼의 산은 하부 용기로 떨어져서 중간 볼로 들어갑니다. , 아연과 반응합니다. 탭이 열린 상태에서 아연이 완전히 용해될 때까지 반응이 계속됩니다. 탭이 닫히면 수소가 중간 볼에서 나오지 않고 산이 아래쪽 용기로 옮겨집니다. 탭이 열리자마자 산이 다시 아연과 접촉하여 수소가 형성됩니다.
2) 수산화물이 양쪽성 특성을 갖는 금속 알칼리(알루미늄, 아연)와의 상호 작용:
Zn + 2 KOH + 2 H 2 O = K 2 + H 2
2 A1 + 6 KOH + 6 H 2 O = 2 K 3 [A1(OH) 6 ] + 3 H 2
3) 전기 전도도를 높이기 위해 전해질(알칼리 또는 알칼리 금속 황산염)을 첨가하는 물의 전기분해. 염화물은 전해 분해로 인해 양극에서 염소가 생성되므로 이러한 목적에는 적합하지 않습니다.
산업계에서 수소는 다른 방식으로 생산됩니다.
1) 특수 장치인 가스 발생기에서 뜨거운 석탄을 수증기로 처리합니다. 수증기와 탄소의 상호 작용의 결과로 수소와 일산화탄소로 구성된 소위 수성 가스가 형성됩니다.
C + H 2 O = CO + H 2
철 촉매가 있는 상태에서 수성 가스를 증기로 처리하면 일산화탄소는 이산화물로 변환되어 고압의 물이나 알칼리 용액에 쉽게 용해됩니다.
CO + H 2 O = CO 2 + H 2
CO 2 + H 2 O H 2 CO 3
CO 2 + 2 KOH = K 2 CO 3 + H 2 O
2) 메탄을 수증기, 이산화탄소 또는 수증기와 이산화탄소의 혼합물로 전환(전환):
CH4 + H2O = CO + 3H2
CH4 + CO2 = 2CO + 2H2
3 CH4 + CO 2 + 2 H 2 O = 4 CO + 8 H 2
이러한 공정은 마그네슘, 알루미늄 및 기타 금속 산화물의 첨가물이 포함된 니켈 기반 촉매가 있는 상태에서 약 1000°C의 온도에서 발생합니다. 생성된 혼합물은 다양한 유기 물질(메탄올, 알데히드, 탄화수소 등)의 생산 또는 수소 생산을 위한 원료로 사용될 수 있습니다(위에서 볼 수 있듯이 혼합물은 수증기로 처리됩니다).
3) 염화물 용액의 전기 분해에 의한 염소 및 알칼리 금속 수산화물 생산의 부산물.
애플리케이션.수소는 화학 산업의 귀중한 원료입니다. 암모니아, 메탄올, 알데히드, 탄화수소를 생산하고, 액체 지방을 고체 지방으로 변환(수소화)하고, 석탄과 연료유의 수소화를 통해 액체 연료를 생산하는 데 사용됩니다. 야금학에서 수소는 금속 및 비금속(게르마늄, 실리콘, 갈륨, 지르코늄, 하프늄, 몰리브덴, 텅스텐 등)을 생성하기 위해 산화물 또는 염화물의 환원제로 사용됩니다. 산소의 연소 온도가 높기 때문에 수소는 금속 절단 및 용접(자동 생성)에도 사용됩니다.
66. 염소
염소는 1774년 스웨덴의 화학자 K. W. Scheele에 의해 발견되었습니다.
자연 속에 있는 것.활성이 높기 때문에 염소는 자연 상태에서 유리 상태로 발생하지 않습니다. 천연 화합물은 널리 알려져 있습니다 - 알칼리 및 알칼리 토금속의 염화물, 가장 일반적인 것은 암염 NaCl, 실비 나이트 (칼륨과 염화나트륨의 혼합물) 및 카르 날 라이트 KS1 MgC1 2 6H 2 O입니다. 염화물은 다음에서 불순물로 발견됩니다. 이 광물은 다른 금속입니다. 바닷물에서는 상당한 양의 금속 염화물이 발견됩니다.
물리적 특성.정상적인 조건에서 염소는 자극적인 냄새가 나는 황록색 가스이며 독성이 있습니다. 공기보다 2.5배 무겁습니다. 20°C에서 약 2배의 염소가 1배의 물에 용해됩니다. 이 용액을 염소수라고 합니다. 대기압에서 염소는 34°C에서 액체 상태로 변하고 101°C에서 고체로 변합니다. 실온에서는 600kPa(6atm)의 압력에서만 액체가 됩니다. 염소는 많은 유기 용매, 특히 사염화탄소에 잘 녹으며 반응하지 않습니다.
화학적 특성.염소 원자의 외부 전자 준위에는 7개의 전자(s 2 p 5)가 포함되어 있으므로 쉽게 전자를 추가하여 Cl 음이온을 형성합니다. 채워지지 않은 d 수준이 존재하기 때문에 1, 3, 5 및 7개의 짝을 이루지 않은 전자가 염소 원자에 나타날 수 있으므로 산소 함유 화합물에서는 +1, +3, +5 및 +의 산화 상태를 가질 수 있습니다. 7.
수분이 없으면 염소는 매우 불활성이지만, 미량의 수분이 있으면 활성이 급격히 증가합니다. 0n은 금속과 잘 상호 작용합니다.
2 Fe + 3 С1 2 = 2 FeС1 3 (염화철(III)
Cu + C1 2 = CuC1 2 (염화구리(II)
그리고 많은 비금속:
H 2 + C1 2 = 2 HCl(염화수소)
2 S + C1 2 = S 2 Cl 2 (염화황(1))
Si + 2 С1 2 = SiС1 4 (염화규소(IV))
2 P + 5 C1 2 = 2 PC1 5 (염화인(V))
염소는 산소, 탄소 및 질소와 직접 상호 작용하지 않습니다.
염소가 물에 용해되면 염산, 염산 및 차아염소산의 두 가지 산이 형성됩니다.
C1 2 + H 2 O = HCl + HClO
염소가 차가운 알칼리 용액과 반응하면 해당 산의 염이 형성됩니다.
С1 2 + 2 NaОН = NaС1 + NaClО + Н 2 О
생성된 용액을 Javel water라고 하며 염소수와 마찬가지로 ClO 이온의 존재로 인해 강한 산화 특성을 가지며 직물과 종이 표백에 사용됩니다. 뜨거운 알칼리 용액의 경우 염소는 해당 염산 및 과염소산 염을 형성합니다.
3 C1 2 + 6 NaOH = 5 NaCl + NaC1O 3 + 3 H 2 O
3 C1 2 + 6 KOH = 5 KCl + KC1O 3 + 3 H 2 O
생성된 염소산칼륨을 베르톨레염이라고 합니다.
가열되면 염소는 많은 유기 물질과 쉽게 상호 작용합니다. 포화 및 방향족 탄화수소에서는 수소를 대체하여 유기염소 화합물과 염화수소를 형성하고 이중 또는 삼중 결합 부위에서 불포화 탄화수소를 결합합니다. 매우 높은 온도에서 염소는 탄소에서 수소를 완전히 제거합니다. 이로 인해 염화수소와 그을음이 생성됩니다. 따라서 탄화수소의 고온 염소화에는 항상 그을음 형성이 동반됩니다.
염소는 강력한 산화제이므로 더 높은 원자가 상태로 산화될 수 있는 원소를 포함하는 복잡한 물질과 쉽게 상호작용합니다.
2 FeС1 2 + С1 2 = 2 FeС1 3
H 2 SO 3 + C1 2 + H 2 O = H 2 SO 4 + 2 HCl
영수증.실험실 조건에서 염소는 이산화망간(가열 시), 과망간산칼륨 또는 베르톨라이트 염과 같은 다양한 산화제에 진한 염산을 작용시켜 얻습니다.
MnO 2 + 4 HCl = MnCl 2 + C1 2 + 2 H 2 O
2 KMnO 4 + 16 HCl = 2 KS1 + 2 MnCl 2 + 5 C1 2 + 8 H 2 O
KC1O 3 + 6 HCl = KC1 + 3 C1 2 + 3 H 2 O
산업계에서 염소는 알칼리 금속 염화물 용액이나 용융물을 전기분해하여 생산됩니다. 용융된 알칼리 금속 염화물을 전기분해하는 동안 알칼리 금속은 음극에서 방출되고 염소는 양극에서 방출됩니다.
2 Na + 2e = 2 Na
2 Сl 2е = Сl 2
용액에서 알칼리 금속 염화물은 이온으로 해리됩니다.
NaС1 Na + С1
약한 전해질인 물도 이온으로 해리됩니다.
H 2 O H + OH
이러한 용액에 전류가 흐르면 두 양이온 - Na 및 H 의 음극과 두 음이온 - OH 및 Cl - 염화물 이온의 양극에서 덜 활동적인 수소 양이온이 방전됩니다.
2 N + 2 e = N 2
2 Cl 2 e = C1 2
전기분해가 진행되면서 음극공간에 OH-이온이 축적되어 가성소다가 생성된다. 염소는 실크와 반응할 수 있으므로 음극과 양극 공간은 반투과성 석면 격막으로 분리됩니다.
애플리케이션.염소의 연간 전 세계 소비량은 100만 톤을 초과합니다. 염소는 종이와 직물을 표백하고 식수를 소독하며 다양한 제품을 생산하는 데 사용됩니다. 살충제, 염산, 유기 염소 물질 및 용제뿐만 아니라 실험실에서도 사용됩니다.
염화수소 및 염산.염화수소는 자극적이고 질식하는 냄새가 나는 무색의 가스입니다. 대기압 및 온도 84 С에서는 액체 상태로 변하고 112 С에서는 경화됩니다. 염화수소는 공기보다 1.26배 무겁습니다. 약 500리터의 염화수소가 0°C의 물 1리터에 용해됩니다.
건조 염화수소는 매우 불활성이며 활성 금속과도 반응하지 않으며 미량의 수분이 있으면 이러한 반응은 매우 활발하게 진행됩니다.
염화수소는 이중 또는 삼중 결합 부위의 불포화 탄화수소에 첨가되어 유기염소 화합물을 형성할 수 있습니다.
실험실 조건에서 염화수소는 건조한 염화나트륨에 진한 황산이 작용하여 생성됩니다.
NaCl + H 2 SO 4 = NaHSO 4 + HCl
2 NaCl + H 2 SO 4 = Na 2 SO 4 + 2 HCl
이들 반응 중 첫 번째 반응은 낮은 열에서 발생하고 두 번째 반응은 더 높은 온도에서 발생합니다. 따라서 첫 번째 방정식에 따라 실험실에서 염화수소를 얻는 것이 더 좋으며, 황산수소나트륨을 형성하는 데 필요한 만큼의 황산을 섭취해야 합니다.
산업계에서 염화수소는 고온에서 건조 염화나트륨에 진한 황산이 작용하고(두 번째 방정식에 따라) 염소 대기에서 수소를 연소시켜 생성됩니다.
H 2 + Cl 2 = 2 HC1
염화수소는 포화 및 방향족 탄화수소의 염소화 과정에서 부산물로 상당한 양이 형성됩니다.
물에 염화수소를 녹인 용액을 염화수소라고 한다. 염산. 이것은 강산이며, 염기성 및 양쪽성 산화물, 염기 및 염과 함께 수소 왼쪽에 있는 전압 계열의 모든 금속과 반응합니다.
Fe + 2 НС1 = FeС1 2 + Н 2
CuO + 2 HCl = CuCl 2 + H 2 O
ZnO + 2 HCl = ZnС1 2 + H 2 O
Fe(OH) 3 + 3 HCl = FeCl 3 + 3 H 2 O
AgNO 3 + HCl = AgCl + HNO 3
Na 2 CO 3 + 2 HCl = 2 NaCl + H 2 O + CO 2
강산 고유의 특성 외에도 이 산은 환원 특성도 특징으로 합니다. 진한 염산은 다양한 강산화제와 반응하여 유리 염소를 형성합니다.
염산의 염을 염화물이라고 합니다. 대부분은 물에 잘 녹고 이온으로 완전히 해리됩니다. 낮은 용질은 염화납 PbCl 2, 염화은 AgCl, 염화수은(I) Hg 2 Cl 2(칼로멜) 및 염화백악(I) CuCl입니다.
염산은 염화수소를 물에 용해시켜 제조됩니다. 이 공정은 액체가 위에서 아래로, 가스가 아래에서 위로 공급되는 특수 흡수탑에서 수행됩니다(역류 원리). 이러한 탑에서는 탑 상부의 신선한 물 부분이 염화수소를 거의 포함하지 않는 가스 흐름과 만나고, 탑 하부의 염화수소 함량이 높은 가스는 진한 염산을 만납니다. 액체에서 기체의 용해도는 기체상의 농도에 정비례하고 용액의 농도에 반비례하기 때문에 이 방법은 기체에서 염화수소를 완전히 추출하고 농축된 염산 용액을 얻습니다. 실온에서 포화된 염화수소 수용액은 42 중량% 이하를 함유할 수 있습니다. % 염화수소 및 그 밀도는 1.20g/cm3를 초과하지 않습니다. 시판되는 염산은 36~37의 염화수소를 함유하고 있으며 밀도는 1.19g/cm 3 입니다.
염산은 내부가 내산성 고무로 코팅된 강철 탱크나 유리 실린더에 저장 및 운송됩니다.
염화수소, 염산 및 그 염은 산업 및 실험실에서 널리 사용됩니다. 염화수소는 유기염소 화합물을 얻기 위해 유기 합성에 사용됩니다. 염산은 염, 산세 금속을 얻는 데 사용되며 화학 실험실에서 시약으로도 사용됩니다.
염산 염 중에서 가장 널리 사용되는 것은 다음과 같습니다.
돌 아니면 요리, NaCl 염. 이는 염소, 나트륨 금속, 가성 소다, 염화수소 및 소다 생산뿐만 아니라 식품 산업의 원료로 사용됩니다.
염화칼륨 KS1. 이는 칼륨 비료뿐만 아니라 기타 칼륨염 및 가성 칼륨 생산을 위한 원료로도 사용됩니다.
염화칼슘 CaC1 2. 무수염은 가스와 많은 유기 액체를 건조하는 데 사용되며 건조기의 건조제로도 사용됩니다. 이 경우 결정성 수화물 CuCl 2 ·nH 2 O(n = 2-6)가 형성됩니다. 포화 염화칼슘 수용액은 부유법에 의한 원료 농축에 사용됩니다.
염화바륨 VaS1 2. 농업에서 살충제로 사용됩니다.
염화 아연 ZnCl2. 산화막(금속 에칭)을 제거하기 위한 납땜에 사용되며, 땅에 묻혔을 때 나무 물체가 썩는 것을 방지하기 위해 함침시키는 데에도 사용됩니다.
염소의 산소 화합물. 염소는 차아염소산, 염소산, 차아염소산 및 과염소산의 네 가지 산소 함유 산을 형성합니다.
차아염소산 HClO는 염소와 물, 염과 강한 무기산의 상호작용에 의해 형성됩니다. 약산이며 매우 불안정합니다. 분해 반응 생성물의 구성은 조건에 따라 다릅니다. 차아염소산을 강하게 조명하고 용액에 환원제가 존재하며 장기간 방치하면 원자 산소가 방출되면서 분해됩니다.
HClO = HCl + O
수분 제거 물질이 있으면 산화염소(I)가 형성됩니다.
2 HClO = 2 H 2 O + Cl 2 O
3 HClO = 2 HCl + HClO 3
따라서 염소가 뜨거운 알칼리 용액과 상호 작용하면 염산과 차아염소산이 아닌 염산과 차아염소산의 염이 형성됩니다.
6 NaOH + 3 Cl 2 = 5 NaCl + NaClO 3 + 3 H 2 O
차아염소산 염(g 및 p o ch l o r t s)은 매우 강력한 산화제입니다. 이는 염소가 추위에 알칼리와 반응할 때 형성됩니다. 동시에 염산 염이 형성됩니다. 이들 혼합물 중에서 가장 널리 사용되는 것은 표백제와 투창수입니다.
염소 또는 표백 석회 CaOCl 2 또는 CaCl(ClO)는 염소와 분말 수산화칼슘의 상호 작용에 의해 형성됩니다. 보풀:
Ca(OH) 2 + Cl 2 = ClOCaCl + H 2 O
2 Ca(OH) 2 + 2 Cl 2 = CaCl 2 + Ca(OCl) 2 + 2 H 2 O
표백제의 품질은 차아염소산염 함량에 따라 결정됩니다. 이는 매우 강한 산화 특성을 갖고 있으며 망간염을 과망간산염으로 산화시킬 수도 있습니다.
5 CaOCl 2 + 2 Mn(NO 3) 2 + 3 Ca(OH) 2 = Ca(MnO 4) 2 + 5 CaCl 2 + 2 Ca(NO 3) 2 + 3 H 2 O
공기 중에 포함된 이산화탄소의 영향으로 염소가 방출되면서 분해됩니다.
CaOCl2 + CO2 = CaCO3 + Cl2
CaCl 2 + Ca(OCl) 2 + 2 CO 2 = 2 CaCO 3 + 2 Cl 2
표백제는 표백제 및 소독제로 사용됩니다.
물질.
아염소산 HClO 2는 알칼리 금속 아염소산염에 진한 황산이 작용하여 형성되며, 이는 음극과 양극 공간 사이에 격막이 없는 상태에서 알칼리 금속 염화물 용액을 전기분해하는 동안 중간 생성물로 얻어집니다. 약하고 불안정한 산이며 산성 환경에서 매우 강한 산화제입니다. 염산과 상호작용하면 염소가 방출됩니다.
HClO 2 + 3 HC1 = Cl 2 + 2 H 2 O
아염소산나트륨은 이산화염소 생성, 물 소독 및 표백제로 사용됩니다.
염소산 HClO 3는 염의 작용에 의해 형성됩니다.
염소산염 - 황산. 이것은 매우 불안정한 산이며 매우 강한 산화제입니다. 희석된 용액에만 존재할 수 있습니다. HClO 3 용액을 진공 상태에서 저온에서 증발시키면 약 40%의 과염소산을 함유한 점성 용액을 얻을 수 있습니다. 산 함량이 높을수록 용액은 폭발적으로 분해됩니다. 환원제가 존재하는 경우 낮은 농도에서도 폭발적인 분해가 발생합니다. 묽은 용액에서 과염소산은 산화 특성을 나타내며 반응은 매우 조용하게 진행됩니다.
HClO 3 + 6 HBr = HCl + 3 Br 2 + 3 H 2 O
위에 표시된 것처럼 과염소산 염(염소산염)은 음극과 양극 공간 사이에 격막이 없는 상태에서 염화물 용액을 전기분해하는 동안뿐만 아니라 염소가 뜨거운 알칼리 용액에 용해될 때 형성됩니다. 전기분해 중에 형성된 염소산칼륨(베르톨레염)은 물에 약간 용해되며 흰색 침전물 형태로 다른 염과 쉽게 분리됩니다. 산과 마찬가지로 염소산염은 상당히 강한 산화제입니다.
KClO 3 + 6 HCl = KCl + 3 Cl 2 + 3 H 2 O
염소산염은 폭발물 생산뿐만 아니라 실험실 조건에서 산소 생산과 염소산 염인 과염소산염에도 사용됩니다. 촉매 역할을 하는 이산화망간 MnO 2 존재하에 베르톨레 염을 가열하면 산소가 방출됩니다. 촉매 없이 염소산칼륨을 가열하면 분해되어 염산과 과염소산의 칼륨염이 형성됩니다.
2KClO3 = 2KCl + 3O2
4 KClO 3 = KCl + 3 KClO 4
진한 황산으로 과염소산염을 처리하면 다음과 같은 결과를 얻을 수 있습니다. 과염소산:
KClO4 + H2SO4 = KHSO4 + HClO4
이것은 가장 강한 산입니다. 모든 산소 함유 염소산 중에서 가장 안정하지만, 무수산은 가열하거나 흔들거나 환원제와 접촉하면 폭발적으로 분해될 수 있습니다. 과염소산의 희석 용액은 매우 안정적이고 사용하기에 안전합니다. 칼륨, 루비듐, 세슘, 암모늄 및 대부분의 유기 염기의 염소산염은 물에 잘 녹지 않습니다.
산업계에서는 Berthollet 염의 전해 산화를 통해 과염소산칼륨을 얻습니다.
2 H + 2 e = H 2 (음극에서)
ClO 3 2 e + H 2 O = ClO 4 + 2 H (양극에서)
67. 브롬
브롬은 1826년 프랑스 화학자 A. J. 발라드(A. J. Balard)에 의해 발견되었습니다.
자연 속에 존재하기. 브롬은 자연에서 자유 상태에서는 발생하지 않습니다. 또한 독립적인 광물을 형성하지 않으며 그 화합물(대부분의 경우 알칼리 금속과 함께)은 암염, 실비나이트, 카르날라이트와 같은 염소 함유 광물의 불순물입니다. 브롬 화합물은 일부 호수와 시추정의 물에서도 발견됩니다.
물리적 특성. 브롬은 불쾌하고 질식하는 냄새가 나는 휘발성이 높은 적갈색 액체입니다. 58.8°C에서 끓고 7.3°C에서 응고됩니다. 20°C의 물 1리터에 브롬 35g이 녹습니다.
브롬은 유기 용매에 훨씬 더 잘 용해됩니다.
화학적 특성. 브롬의 화학적 성질은 염소와 유사합니다. 원자의 외부 전자 수준에는 7개의 전자(s 2 p 5)가 포함되어 있으므로 쉽게 전자를 추가하여 Br 이온을 형성합니다. 채워지지 않은 d 수준이 존재하기 때문에 브롬은 1, 3, 5 및 7개의 짝을 이루지 않은 전자를 가질 수 있으며 산소 함유 화합물에서는 +1, +3, +5 및 +7의 산화 상태를 나타냅니다.
염소와 마찬가지로 브롬도 금속 및 비금속과 상호작용합니다.
2 Al + 3 Br 2 = 2 AlBr 3 (브롬화알루미늄)
H 2 + Br 2 = 2 HBr(브롬화수소)
2 P + 3 Br 2 = 2 PBr 3 (브롬화인(III))
브롬의 모든 반응은 염소보다 덜 에너지적으로 진행됩니다. 브롬은 또한 물과 덜 격렬하게 반응합니다. 물에 용해되면 브롬의 일부만 반응하여 브롬화수소산과 차아브롬산을 형성합니다.
Br 2 + H 2 O НВr + НВrО
찬물에 브롬을 알칼리 용액에 녹이면 염이 생긴다.
이 산:
Br 2 + 2 NaOH = NaBr + NaBrO + H 2 O
브롬은 또한 염소보다 포화 및 불포화 탄화수소와 덜 활발하게 반응합니다.
C 6 H 6 + Br 2 = C 6 H 5 Br + HBr
CH 2 =CH 2 + Br 2 = CH 2 BrCH 2 Br
브롬은 염소와 마찬가지로 산화제입니다. 따라서 아황산을 황산으로 쉽게 산화시킵니다.
H 2 SO 3 + Br 2 + H 2 O = H 2 SO 4 + 2 HBr
황화수소 용액에 브롬수를 첨가하면 황이 방출되어 적갈색이 사라지고 용액이 흐려집니다.
H 2 S + Br 2 = 2 HBr + S
영수증. 실험실 조건에서 브롬은 황산 매질에서 브롬산 또는 그 염의 다양한 산화제에 작용하여 얻습니다.
2 КМnO 4 + 16 НВr = 2 КВr + 2 МnВr 2 + 5 Вr 2 + 8 Н 2 О
KClO 3 + 6 HBr = KCl + 3 Br 2 + 3 H 2 O
2 KMnO 4 + 10 KBr + 8 H 2 SO 4 = 6 K 2 SO 4 + 2 MnSO 4 + 5 Br 2 + 8 H 2 O
산업계에서는 다양한 브롬화물에 염소를 작용시켜 브롬을 얻습니다.
2KBr + Cl 2 = 2 KCl + Br 2
애플리케이션. 브롬은 페인트, 바니시, 제약 산업에 사용되는 다양한 유기브로민 화합물을 생산하는 데 사용됩니다. 필름 및 사진 재료 제조 시 감광성 물질로 사용되는 브롬화은을 생산하는 데 상당한 양의 브롬이 소비됩니다.
브롬화수소 및 브롬화수소산. 브롬화수소는 자극적인 냄새가 나는 무색의 기체로 -66.8°C에서 액체로 변하고 -87°C에서 고체화됩니다. 약 500리터의 브롬화수소가 0°C의 물 1리터에 용해됩니다.
브롬화수소와 그 수용액인 브롬화수소산의 화학적 성질은 염화수소 및 염산의 성질과 유사하지만, 유일한 차이점은 브롬화수소산이 더 강한 산이고 브롬화수소가 더 강한 환원제라는 점입니다.
브롬화수소는 불포화 탄화수소의 이중 또는 삼중 결합에 쉽게 부착되어 해당 유기 화합물의 브롬 유도체를 형성합니다.
CH 3 CH = CH 2 + HBr = CH 3 CHBrCH 3
프로필렌 이소프로필 브로마이드
브롬화수소는 쉽게 산화되기 때문에 가열 시 알칼리 금속 브롬화물에 진한 황산을 작용시켜 얻을 수 없습니다. 왜냐하면 황산은 브롬화물을 산화시키기 때문입니다.
브롬을 제거하려면:
2KBr + 2H2SO4 = K2SO4 + SO2 + Br2 + 2H2O
브롬이 없는 브롬화수소는 삼브롬화인을 물과 반응시켜 얻습니다.
PBr 3 + 3 H 2 O = H 3 PO 3 + 3 HBr
브롬화수소산은 다양한 금속의 브롬화물, 특히 감광성 필름 재료 생산에 사용되는 브롬화은을 생산하는 데 사용됩니다.
대부분의 브롬산 염(브롬산)은 물에 잘 녹습니다. 불용성 염은 브롬화은 AgBr, 브롬화 수은(I) Hg 2 Br 2, 브롬화 구리(I) CuBr 및 브롬화 납 PbBr 2입니다.
브롬 산소 화합물염소의 산소 화합물과 유사하지만 산은 더 약한 전해질이고 더 약한 산화제입니다. 분석 화학 및 실험실 실습에 사용되는 브롬산 칼륨 KBrO 3를 제외하고는 실질적인 의미가 없습니다.
68. 요오드
요오드는 1811년 프랑스의 초석 화학자 B. Courtois에 의해 발견되었습니다.
자연 속에 존재하기. 요오드 화합물은 독립적인 침전물을 형성하지 않지만 염소 광물에서 불순물로 발견됩니다. 요오드 염은 시추공의 물에 포함되어 있습니다. 일부 해조류에는 상당량의 요오드가 함유되어 있으며, 그 소는 이 원소를 생산하는 원료로 사용될 수 있습니다.
물리적 특성. 요오드는 희미한 금속 광택을 지닌 고체의 짙은 회색 결정질 물질입니다. 천천히 가열하면 쉽게 승화하여 보라색 증기를 생성합니다. 요오드는 빠르게 가열하면 114°C에서 녹고 183°C에서 끓습니다. 유기용매와 KI 수용액에 잘 녹는다. CI가 존재하는 경우 물에 대한 용해도는 매우 낮습니다(20°C에서 요오드 290mg이 물 1리터에 용해됨).
화학적 특성. 요오드의 화학적 성질은 염소 및 브롬과 유사하지만 활성이 덜합니다. 가열된 경우에만 수소와 반응하며 반응이 완전히 진행되지는 않습니다.
I 2 + H 2 = 2 HI(요오드화수소)
가열하면 요오드는 인과 반응합니다.
2 P+ 3I 2 = 2 PI 3 (요오드화인(III))
촉매 역할을 하는 물이 있을 때 요오드는 알루미늄과 강렬하고 거의 폭발적으로 반응합니다.
2 Al + 3I 2 = 2 AlI 3 (요오드화알루미늄)
요오드는 물과 거의 반응하지 않지만 알칼리와 유사하게 반응합니다.
염소와 브롬:
나는 2 + 2 KOH = KI + KIO 3 + H 2 O
3I 2 + 6 KOH = 5 KI + KIO 3 + 3 H 2 O
요오드는 강한 환원제가 존재할 때 나타나는 산화 특성을 가지고 있습니다. 아황산 및 황화수소와 쉽게 상호 작용합니다.
H 2 SO 3 + I 2 + H 2 O = H 2 SO 4 + 2 HI
H 2 S + I 2 = 2 HI + S
요오드는 티오황산염과 반응할 때 황산염을 형성하지 않습니다.
염소, 브롬, 테트라티오네이트의 경우:
I 2 + 2 Na 2 S 2 O 3 = 2 NaI + Na 2 S 4 O 6
이 반응은 분석 화학에 사용됩니다. 그 응용에 기초한 분석 방법을 요오드 측정법이라고 합니다. 반응의 완료는 요오드와 전분의 상호 작용으로 인해 파란색이 나타나거나 사라지는 것으로 결정됩니다.
영수증. 실험실에서 요오드는 다양한 산화제(KMnO 4, MnO 2, KClO 3, KBrO 3, 심지어 FeCl 3 및 CuSO 4)에 대한 요오드화수소산의 작용을 통해 염소 또는 브롬 생산과 유사하게 얻을 수 있습니다.
2 KMnO 4 + 16 HI = 2 KI + 2 MnI 2 + 5I 2 + 8 H 2 O
КВrО 3 + 6 НI = КВr + 5 I 2 + 3 Н 2 О
2 FeC 3 + 2 HI = 2 FeCl 2 + I 2 + 2 HCl
2 CuSO 4 + 4 HI = 2 CuI + 2 H 2 SO 4 + I 2
산업계에서는 요오드화물에 염소가 작용하여 요오드를 얻습니다.
2 KI + CI 2 = 2 KCl + I 2
애플리케이션. 요오드는 실험실 실습과 의학에 사용됩니다. 이는 많은 의약품 제제에 포함되어 있으며 5% 알코올 수용액으로 상처 치료에 사용됩니다. 신체에 요오드가 부족하면 심각한 질병(갑상선종)이 발생합니다.
요오드화수소 및 요오드화수소산. 요오드화수소는 자극적인 냄새가 나는 무색의 기체로 35.4°C에서 액체로 변하고 50.8°C에서 고체화됩니다. 약 500리터의 요오드화수소가 물 1리터에 용해되어 요오드화수소산을 형성합니다. 무산소산 중에서 가장 강한 산이다. 이는 염산 및 브롬화수소산보다 훨씬 강합니다.
요오드화수소산은 매우 강력한 환원제이므로 대기 산소에 의해서도 산화되어 용액이 갈색으로 변합니다.
4 HI + O 2 = 2 H 2 O + 2 I 2
밝은 곳에서는 산화가 어두운 곳보다 더 활발하게 일어나므로 요오드화수소산 용액은 어두운 유리 용기에 보관됩니다.
대부분의 요오드화수소산 염(o d 및 d ov v)은 물에 잘 녹습니다. 요오드화수소의 불용성 염
산은 요오드화은 AgI, 요오드화 수은 Hg 2 I 2, 요오드화 구리 CuI 및 요오드화 납 PbI 2입니다.
요오드화수소는 포스포트리요오드화물에 물이 작용하여 생성됩니다.
PI 3 + 3 H 2 O = H 3 PO 3 + 3 HI
거의 모든 요오드화물이 진한 황산에 의해 유리 요오드로 산화되기 때문에 알칼리 금속 요오드화물에 황산을 작용시켜 요오드화수소를 얻는 것은 불가능합니다.
2 KI + 2 H 2 SO 4 = K 2 SO 4 + SO 2 + I 2 + 2 H 2 O
8 KI + 4 H 2 SO 4 = 3 K 2 SO 4 + K 2 S + 4I 2 + 4 H 2 O
요오드화수소산은 실험실 실습에서만 사용됩니다.
요오드의 산소 화합물브롬의 산소 화합물과 유사합니다. 약산 HIO, HIO 3 및 HIO 4도 약산화제입니다. 그들은 실험실 실습에서만 적용됩니다.
69. 불소
불소는 1886년 프랑스 화학자 A. Moissan에 의해 자유 상태에서 처음으로 얻어졌습니다.
자연 속에 존재하기. 불소염 중에서 자연에서 가장 흔한 것은 형석(형석) CaF 2입니다. 인회석에는 불화칼슘 형태의 불소도 포함되어 있습니다. 3Ca 3 (PO 4) 2 CaF 2 (또는 Ca 5 (PO 4) 3 F).
물리적 특성. 정상적인 조건에서 불소는 매운 냄새가 나는 무색 가스이며 두꺼운 층에서는 녹황색입니다. 181.1 С에서 불소는 액체 상태로 변하고 219.6 С에서는 고체로 변합니다. 불소의 용해도는 거의 모든 용매를 파괴하기 때문에 연구되지 않았습니다.
화학적 특성.불소 원자의 외부 전자층에는 7개의 전자(s 2 p 5)가 포함되어 있습니다. 이 층은 염소, 브롬 및 요오드 원자보다 핵에 더 가깝기 때문에 불소는 모든 할로겐보다 전자를 더 강하게 끌어당깁니다. 이것은 예외적으로 높은 화학적 활성을 설명합니다. 불소에는 d 수준이 없으므로 짝을 이루지 않은 전자를 두 개 이상 가질 수 없으며 하나가 아닌 원자가 상태를 나타낼 수 있습니다.
불소는 거의 모든 원소와 반응하며, 염소나 산소보다 반응이 더 격렬하게 진행됩니다. 일부 금속(Pb, Cu, Ni, Mg)의 표면에는 치밀한 불소막이 형성되어 추가 반응을 방지합니다.
분말 형태의 비금속은 불소와 매우 격렬하게 반응하지만 소형 형태에서는 훨씬 더 어렵습니다. 그을음 형태의 탄소는 불소 분위기에서 즉시 연소되고, 흑연은 고온에서만 불소와 반응합니다. 불소는 산소 및 질소와 직접 상호 작용하지 않습니다.
영수증. 유리 불소는 반응성이 높기 때문에 분리하기가 매우 어렵습니다. 납 장비에서 이불화칼륨 KF·HF 용융물을 전기분해하여 소량으로 얻습니다(전해조 벽의 내부 표면에 형성된 불화납 PbF2는 장치가 파괴되지 않도록 보호합니다).
애플리케이션. 유리불소는 불소수지(테플론), 고온 윤활유, 냉동기용 유체(프레온) 생산의 원료로 사용되는 불소화 유기화합물을 생산하는 데 사용됩니다.
불화수소, 불산. 불화수소는 자극적인 냄새가 나는 기체입니다. 19.9°C에서는 액체 상태로 변하고, 83.1°C에서는 고체로 변합니다. 액체 불화수소는 어떤 비율로든 물과 혼합됩니다. 물에 불화수소가 용해된 용액을 불화수소산 또는 불화수소산이라고 합니다. 다른 할로겐화수소산과 달리 불화수소산은 약산입니다. 이는 많은 금속, 염기성 산화물, 염기 및 염과 잘 반응합니다. 강산이 있으면 다른 산에 용해되지 않는 많은 희귀 금속(티타늄, 지르코늄, 니오븀, 탄탈륨 등)이 용해됩니다. 불산은 H 3 FeF 6, H 2 TiF 6, H 3 AlF 6과 같은 많은 금속과 매우 강한 불화 복합물을 형성합니다. 나트륨 염 Na 3 AlF 6은 용융물에서도 해리되어 AlF 6 3 이온을 형성합니다. 불화수소와 불산은 이산화규소와 반응하여 휘발성 화합물 SiF4를 형성합니다.
SiO 2 + 4 НF = SiF 4 + 2 Н 2 О
유리에는 상당한 양의 이산화규소가 포함되어 있으므로 불산은 유리를 부식시키므로 고분자 재료(폴리에틸렌, 불소수지 또는 에보나이트)로 만든 용기에 보관하거나 내부에 파라핀 층을 코팅한 유리에 보관할 수 있습니다.
불화수소는 유기불소 화합물 생산, 불소플라스틱 생산, 희귀 금속 야금, 특정 금속의 표면 처리 시 에칭제로 사용됩니다.
불화수소는 형석 CaF 2에 진한 황산을 작용시켜 얻습니다.
CaF 2 + H 2 SO 4 = CaSO 4 + 2 HF
인회석 가공 과정에서 부산물로 불화수소가 생성되기도 하는데,
70. 망간
망간은 1774년 K.V. Scheele와 Yu.
자연 속에 존재하기. 자연 분포 측면에서 망간은 철 다음으로 높습니다. 지각의 함량은 0.1%입니다. 광석에서 망간이 발견되는 주요 광물은 피로루사이트 MnO 2 입니다. 피로루사이트 망간 광석 외에도 브라운나이트 Mn 2 O 3, 망가나이트 MnO(OH), 하우스만나이트 Mn 3 O 4 및 망간 스파 MnCO 3를 함유한 망간 광석이 있습니다. 또한, 산화물 형태의 망간은 거의 모든 철광석에서 발견됩니다.
물리적 특성. 망간은 은백색 금속으로 밀도는 7.2g/cm3입니다. 단단하고 부서지기 쉬우며 1260°C에서 녹고 2120°C에서 끓습니다. 공기 중에서 금속은 산화막의 잡색 반점으로 덮여 추가 산화로부터 금속을 보호합니다. 철과 함께 망간은 임의의 비율의 성분(페로망간)과 합금을 형성합니다.
화학적 특성. 망간은 +2, +3, +4, +6 및 +7의 산화 상태를 나타내는 다양한 화합물을 형성합니다. 다른 산화 상태를 갖는 망간 화합물은 흔하지 않으며 매우 드뭅니다.
금속 망간이 다양한 비금속과 상호작용할 때 망간(II) 화합물이 형성됩니다.
Mn + C 2 = MnCl 2 (염화망간(II))
Mn + S = MnS(망간(II) 황화물)
3 Mn + 2 P = Mn 3 P 2 (망간(II) 인화물)
3 Mn + N 2 = Mn 3 N 2 (망간(II) 질화물)
2 Mn + N 2 = Mn 2 Si (망간(II) 규화물)
망간은 수소 방출과 함께 비산화성 산에 쉽게 용해됩니다.
Mn + 2 HCl = MnCl 2 + H 2
Mn + H 2 SO 4 (희석) = MnSO 4 + H 2
또한 가수분해 시 산성 반응을 일으키는 화합물이 있는 경우 물에 용해됩니다.
Mn + 2 H 2 O + 2 NH 4 Cl = MnCl 2 + 2 NH 4 OH + H 2
산화성 산에 망간이 용해되면 다음과 같은 산의 환원 생성물이 방출됩니다.
Mn + 2 H 2 SO 4 (농축) = MnSO 4 + SO 2 + 2 H 2 O
Mn + 4 HNO 3 (농축) = Mn(NO 3) 2 + 2 NO + 2 H 2 O
3 Mn + 8 HNOz (희석) = 3 Mn(NO 3) 2 + 2 NO 2 + 4 H 2 O
망간은 많은 금속 산화물을 감소시킬 수 있으므로 야금에 사용됩니다.
5 Mn + Nb 2 O 5 = 5 MnO + 2 Nb
3 Mn + Fe 2 O 3 = 3 MnO + 2 Fe
미세하게 분산된 상태(분말)에서 망간은 압축된 상태보다 반응성이 더 큽니다.
영수증. 망간 금속은 소성된 산화물을 알루미늄으로 환원시켜 얻습니다. 알루미늄은 이산화망간과 매우 격렬하게 반응하므로 소성된 피로루사이트가 사용됩니다. 피로루사이트가 소성되면 산화망간 Mn 3 O 4가 형성되어 알루미늄과 더 차분하게 반응합니다.
3 MnO 2 = Mn 3 O 4 + O 2
3 Mn 3 O 4 + 8 Al = 4 Al 2 O 3 9 Mn
야금에 사용되는 페로망간을 얻으려면 철광석과 피로루사이트의 혼합물을 전기로에서 코크스와 함께 환원합니다.
Fe 2 O 3 + MnO 2 + 5 C = 2 Fe Mn + 5 CO
애플리케이션. 페로망간 형태의 망간은 철 야금에 사용됩니다.
망간의 산소 화합물. 망간은 산화물 MnO, Mn 2 O 3, MnO 2, MnO 3, Mn 2 O 7, 수산화물 Mn(OH) 2, Mn(OH) 4, H 2 MnO 4, HMnO 4 및 해당 화합물을 형성합니다.
일산화망간 MnO는 녹회색 분말로 기본 특성을 갖고 있어 산 및 산성 산화물과 반응합니다.
MnO + 2 HCl = MnCl 2 + H 2 O
MnO + SO3 = MnSO4
일산화망간은 물에 거의 녹지 않습니다.
수산화 망간(II) Mn(OH) 2는 공기 중에서 쉽게 산화되어 갈색 수산화 망간(IV)으로 변하는 백색 물질입니다.
2 Mn(OH) 2 + O 2 + 2 H 2 O = 2 Mn(OH) 4
수산화 망간(II)은 염과 알칼리의 상호 작용에 의해 형성됩니다.
MnSO 4 + 2 KOH = Mn(OH) 2 + K 2 SO 4
수산화망간(II)은 기본적인 특성을 가지고 있습니다. 이는 산 및 산성 산화물과 반응합니다.
Mn(OH) 2 + 2 HCl = MnCl 2 + 2 H 2 O
Mn(OH) 2 + SO 3 = MnSO 4 + H 2 O
수산화망간(II)은 환원 특성을 가지고 있습니다. 강한 산화제가 있으면 산화되어 과망간산염으로 변할 수 있습니다.
2 Mn(OH) 2 + 5 KBrO + 2 KOH = 2 KMnO 4 + 5 KBr + 3 H 2 O
산화제의 양이 부족하면 이산화망간이 형성됩니다.
5 Mn(OH) 2 + KBrO = 5 MnO 2 + KBr + H 2 O
대부분의 망간(II) 염은 물에 잘 녹습니다. 건조되면 결정성 수화물은 희미한 분홍색으로 변합니다. 망간(II)의 불용성 염은 탄산 MnCO 3, 황화물 MnS 및 인산염 Mn 3 (PO 4) 2입니다. 산성 환경에서 강한 산화제에 노출되면 산화제의 양에 따라 망간(II)이 MnO 2 또는 과망간산염으로 변환될 수 있습니다.
Mn(NO 3) 2 + PbO 2 = MnO 2 + Pb(NO 3) 2
2 Mn(NO 3) 2 + 5 РbО 2 + 6 НNO 3 = 2 НМnО 4 + 5 Рb(NO 3) 2 + 2 Н 2 О
망간(III) 산화물 Mn 2 O 3은 자연에서 광물 브라운나이트의 형태로 발생합니다. 실험실에서는 530~940°C의 온도에서 조심스럽게 가열하여 MnO2가 형성됩니다.
4 MnO 2 = 2 Mn 2 O 3 + O 2
더 높은 온도에서는 이산화물의 분해로 인해 Mn 3 O 4 산화물이 형성됩니다.
3 MnO 2 = Mn 3 O 4 + O 2
망간(III) 화합물은 실질적인 의미가 없으며,
이산화망간 MnO 2 또는 망간(IV) 산화물, 짙은 회색 물질. 공기 중에서 530°C로 가열하면 이산화망간이 분해되어 위에 표시된 것처럼 산소를 방출합니다. 진공 상태나 환원제가 있는 경우 이 반응은 훨씬 더 강하게 진행됩니다.
이산화망간을 진한 질산과 함께 끓이면 망간(II)염이 형성되고 산소가 방출됩니다.
2 MnO 2 + 4 HNO 3 = 2 Mn(NO 3) 2 + 2 H 2 O + O 2
산성 환경에서 이산화망간은 산화 특성을 나타냅니다.
MnO 2 + 4 HCl = MnCl 2 + Cl 2 + 2 H 2 O
MnO 2 + 2 FeSO 4 + 2 H 2 SO 4 = MnSO 4 + Fe 2 (SO 4) 3 + 3 H 2 O
산화 망간(IV)이 공기 접근 없이 알칼리와 융합되면 망가나이트 또는 망간산염(IV)이 형성됩니다.
2 MnO 2 + 2 KOH = K 2 MnO 3 + H 2 O
산화제 역할을 하는 대기 산소가 있으면 융합 중에 망간염(VI)이 형성됩니다.
2MnO2+4KOH+O2=2K2MnO4+2H2O
망간산 칼륨 K 2 MnO 4는 자발적으로 과망간산 칼륨과 이산화망간으로 분해됩니다.
3 K 2 MnO 4 + 2 H 2 O = 2 KMnO 4 + MnO 2 + 4 KOH
과망간산 칼륨 KMnO 4는 실험실, 산업, 의학 및 일상 생활에서 널리 사용됩니다. 매우 강한 산화제입니다. 환경에 따라 환원제 존재 시 망간은 다양한 산화 상태로 환원될 수 있습니다. 산성 환경에서는 항상 Mn(II)으로 환원됩니다.
2 KMnO 4 +10 KVg + 8 H 2 SO 4 = 2 MnSO 4 + 6 K 2 SO 4 + 5 Br 2 + 8 H 2 O
망간산 칼륨 K 2 MnO 4 및 이산화망간도 유사하게 작용합니다.
알칼리성 환경에서 과망간산칼륨은 망간산염으로 환원됩니다.
2 KMnO 4 + K 2 SO 3 + 2 KOH = K 2 SO 4 + 2 K 2 MnO 4 + H 2 O
중성 또는 약알칼리성 환경에서 과망간산칼륨은 이산화망간으로 환원됩니다.
2 KMnO 4 + C 6 H 5 CH 3 = 2 KOH + 2 MnO 2 + C 6 H 5 COOH
2 KMnO 4 + 3 MnSO 4 + 2 H 2 O = 5 MnO 2 + K 2 SO 4 + 2 H 2 SO 4
후자의 반응은 분석화학에서 망간의 정량적 측정을 위해 사용됩니다.
이전에는 이산화망간이나 망간산칼륨을 산화시켜 과망간산칼륨을 제조했습니다. 이산화망간은 알칼리와 융합되면 질산염으로 산화됩니다.
MnO 2 + KNO 3 + 2 KOH = K 2 MnO 4 + KNO 2 + H 2 O
생성된 용액 내 망간산칼륨은 과망간산칼륨과 이산화망간으로 자발적으로 분해됩니다.
3 K 2 MnO 4 + 2 H 2 O = 2 KMnO 4 + MnO 2 + 4 KOH
두 번째 방법에 따르면 망간산 칼륨을 염소로 산화했습니다.
2 K 2 MnO 4 + Cl 2 = 2 KMnO 4 + 2 KCl
현재 과망간산칼륨은 망간산염의 전해 산화에 의해 얻어집니다.
MnO 4 2 e = MnO 4
과망간산 칼륨은 산업 및 실험실 실습 모두에서 널리 사용됩니다. 면, 양모, 방적 섬유를 표백하고 오일을 정화하며 다양한 유기 물질을 산화시키는 데 사용됩니다. 실험실 실습에서는 염소와 산소를 생성하는 데 사용됩니다.
2 KMnO 4 + 16 HCl = 2 KCl + 2 MnCl 2 + 5 Cl 2 + 8 H 2 O
2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
분석 화학에서 과망간산 칼륨은 환원 특성을 가진 물질 (Fe 2 , Sn 2 , AsO 3 3 , H 2 O 2 등)의 정량 측정에 사용됩니다. 이 분석 방법을 과망간 측정법이라고 합니다.
주기율표의 VII족에 포함된 원소는 주 하위 그룹인 할로겐 하위 그룹과 보조 하위 그룹인 망간 하위 그룹의 두 하위 그룹으로 나뉩니다. 수소도 이 그룹에 속하지만, 원자의 원자가 외부 원자가 수준에 단일 전자가 있으므로 그룹 I에 배치되어야 합니다. 그러나 수소는 주요 하위 그룹의 원소인 알칼리 금속과 2차 하위 그룹의 원소인 구리, 은 및 금과 공통점이 거의 없습니다. 동시에 할로겐과 마찬가지로 활성 금속과 반응하여 전자를 추가하고 할로겐화물과 유사한 수소화물을 형성합니다.
할로겐의 하위 그룹에는 불소, 염소, 브롬, 요오드 및 아스타틴이 포함됩니다. 처음 네 가지 원소는 자연에서 발견되고 마지막 원소는 인공적으로 얻어지므로 다른 할로겐에 비해 연구가 훨씬 적습니다. 할로겐이라는 단어는 소금을 형성한다는 의미입니다. 하위 그룹의 요소는 많은 금속과 쉽게 반응하여 염을 형성하기 때문에 이 이름을 받았습니다. 모든 할로겐은 외부 전자 껍질 s 2 p 5의 구조를 갖습니다. 따라서 그들은 쉽게 전자를 받아들여 안정적인 희가스 전자 껍질(s 2 p 6)을 형성합니다. 불소는 하위 그룹에서 원자 반경이 가장 작습니다. 나머지는 F 계열에서 증가합니다.< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 пм. В таком же порядке уменьшается сродство атомов элементов к электрону. Галогены - очень активные элементы. Они могут отнимать, электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например, фтор вытесняет хлор из хлоридов, хлор - бром из бромидов, а бром - иод из иодидов. Из всех галогенов только фтор, находящийся во II периоде, не имеет незаполненного d-уровня. По этой причине он не может иметь больше одного неспаренного электрона и проявляет валентность только -1. В атомах других галогенов d-уровень не заполнен, что дает им возможность иметь различное количество неспаренных электронов и проявлять валентность -1, +1, +3, +5 и +7, наблюдающуюся в кислородных соединениях хлора, брома и иода К подгруппе марганца принадлежат марганец, технеций и рений. В отличии от галогенов элементы подгруппы марганца имеют на внешнем электронном уровне всего два электрона и поэтому не проявляют способности присоединять электроны, образуя отрицательно заряженные ионы.Марганец распространен в природе и широко используется в промышленности.Технеций радиоактивен, в природе не встречаемся, а получен искусственно (впервые - Э. Сегре и К.Перрье, 1937}. Этот элемент образуется вследствие радиоактивного распада урана. Рений относится к числу рассеянных элементов. Он не образует самостоятельных минералов, а встречается в качестве спутника некоторых минералов, особенно молибденовых. Он был открыт В. и И. Ноддак в 1925 г. Сплавы, имеющие небольшие добавки рения, обладают повышенной устойчивостью против коррозии. Добавка рения к и ее сплавам увеличивает их механическую прочность. Это свойство рения позволяет применять его вместо благородного металла иридия. Платино-платинорениевые термопары работают лучше платино-платиноиридиевых, но их нельзя использовать при очень высоких температурах, так как образуется летучее соединение Re 2 O 7 .
비금속의 특징은 원자의 외부 에너지 준위에서 금속에 비해 전자 수가 더 많다는 것입니다. 이는 금속보다 추가 전자를 부착하고 더 높은 산화 활성을 나타내는 능력이 더 크다는 것을 결정합니다. 특히 강한 산화 특성, 즉 전자를 추가하는 능력은 VI-VII족의 2주기와 3주기에 위치한 비금속에서 나타납니다. 불소, 염소 및 기타 할로겐 원자의 궤도에서 전자 배열을 비교하면 그들의 독특한 특성을 판단할 수 있습니다. 불소 원자에는 자유 궤도가 없습니다. 따라서 불소 원자는 원자가 I과 산화 상태 1만을 나타낼 수 있습니다. 가장 강한 산화제는 불소입니다. 예를 들어 염소 원자와 같은 다른 할로겐 원자에는 동일한 에너지 수준의 자유 d-궤도가 있습니다. 덕분에 전자쌍은 세 가지 다른 방식으로 발생할 수 있습니다. 첫 번째 경우 염소는 +3의 산화 상태를 나타내며 염에 해당하는 아염소산 HClO2를 형성할 수 있습니다. 이는 아염소산염(예: 아염소산칼륨 KClO2)에 해당합니다. 두 번째 경우, 염소는 염소의 산화 상태가 +5인 화합물을 형성할 수 있습니다. 이러한 화합물에는 차아염소산 HClO3 및 그 염(염소산염, 예: 염소산칼륨 KClO3(베르톨렛 염))이 포함됩니다. 세 번째 경우, 염소는 예를 들어 과염소산 HClO4 및 그 염, 과염소산염(과염소산칼륨 KClO4)에서 +7의 산화 상태를 나타냅니다.
Mn 2+ 이온의 특정 분석 반응
1.5.5. 비스무트산 나트륨 NaBiO 3를 사용한 산화는 다음 방정식에 따라 진행됩니다.
2Mn(NO 3) 2 + 5NaBiO 3 + 16HNO 3 = 2HMnO 4 + 5Bi(NO 3) 3 + 5NaNO 3 + 7H 2 O.
반응은 추위에 발생합니다. 반응 실행:망간염 용액 1~2방울에 6M HNO 3 용액 3~4방울과 H 2 O 5~6방울을 첨가한 후, 주걱으로 NaBiO 3 분말을 약간 첨가한다. 시험관의 내용물을 섞은 후 1~2분간 방치한 후 원심분리하여 여분의 비스무트산나트륨을 분리한다. Mn 2+가 존재하면 가장 강력한 산화제 중 하나인 망간산이 형성되어 용액이 보라색으로 변합니다.
1.5.6. 가열 시 질산 매질에서 이산화납을 사용한 PbO 2 산화:
2Mn(NO 3) 2 + 5PbO 2 + 6HNO 3 → 2HMnO 4 + 5Pb(NO 3) 2 + 2H 2 O.
반응 실행:약간의 PbO 2 분말을 취하여 시험관에 넣고 거기에 6 M HNO 3 4~5방울을 넣고 저으면서 가열한다. 보라색의 출현은 Mn 2+의 존재를 나타냅니다.
1.5.7. 분석에서 중요한 것은 Mn 2+와 알칼리 금속 탄산염, 인산수소나트륨과의 반응, 과황산 암모늄과의 산화 반응, Mn 4+ 화합물에 의한 벤지딘의 산화, Mn 2+ 이온에 의한 AgCl의 금속 은으로의 환원입니다.
88. VIII B 그룹의 요소. 가장 중요한 화합물의 일반적인 특성. 생물학적 역할. Fe 3+ 및 Fe 2+ 이온에 대한 분석 반응.
철 하위 그룹- 화학 원소 주기율표의 8족 화학 원소(오래된 분류에 따름 - VIII족의 2차 하위 그룹 원소). 그룹에는 다음이 포함됩니다. 철철, 루테늄루와 오스뮴오. 원자의 전자적 구성에 기초하여 인공적으로 합성된 원소도 같은 족에 속함 해시 Hs는 1984년 중이온연구센터(독일)에서 발견되었습니다. Gesellschaft für Schwerionenforschung, GSI), 독일 다름슈타트에서 UNILAC 가속기의 철-58 이온 빔으로 납(208 Pb) 표적을 폭격한 결과입니다. 실험 결과, 3,265개의 Hs 핵이 합성되었으며, 이는 α-붕괴 사슬의 매개변수에 의해 확실하게 식별되었습니다. 동시에 독립적으로 동일한 반응이 JINR(러시아 Dubna)에서 연구되었으며, 여기서 253 Es 핵의 α-붕괴에 대한 3가지 사건의 관찰을 바탕으로 이 반응에서 265 Hs 핵이 대상이라는 결론을 내렸습니다. α-붕괴로 합성되었다. 모든 8족 원소는 원자가 껍질에 8개의 전자를 포함합니다. 그룹의 두 가지 요소인 루테늄과 오스뮴은 백금 금속 계열에 속합니다. 다른 족과 마찬가지로 8족 원소의 구성원은 특히 외부 껍질에서 전자 구성 패턴을 나타내지만, 이상하게도 루테늄은 이러한 경향을 따르지 않습니다. 그러나 이 그룹의 원소는 물리적 특성과 화학적 거동에서도 유사성을 나타냅니다. 철은 자연에서 순수한 형태로 거의 발견되지 않으며 철-니켈 운석에서 가장 자주 발견됩니다. 지각 내 철의 함유량은 4.65%(산소, 규소, 알루미늄에 이어 4위)입니다. 철은 또한 지구 핵의 대부분을 구성하는 것으로 알려져 있습니다.
루테늄은 살아있는 유기체에서 발견되는 유일한 백금 금속입니다. (일부 출처에 따르면 - 플래티넘이기도 함) 주로 근육 조직에 집중되어 있습니다. 더 높은 수준의 산화 루테늄은 매우 독성이 강하며 강력한 산화제이므로 가연성 물질의 연소를 일으킬 수 있습니다.
분석반응
Fe 2+ 양이온과 함께 칼륨 헥사시아노철산염(III) K 3 은 "Turnboole blue"의 파란색 침전물을 형성합니다.
3FeSO 4 + 2K 3 → Fe 3 2 ↓+ 3K 2 SO 4 ,
3Fe 2+ + 2Fe(CN) 6 3– → Fe 3 2 ↓.
침전물은 산에는 용해되지 않지만 알칼리와 함께 분해되어 Fe(OH) 2를 형성합니다. 시약이 과량일 경우 침전물은 녹색으로 변합니다. 반응은 고농도에서 시약에 용액이 갈색을 띠게 하는 Fe 3+ 이온과 산에 용해되는 약한 색상의 침전물을 시약에 제공하는 Mn 2+ 및 Bi 3+ 이온에 의해 방해됩니다. 반응 수행.시험관에 FeSO4 용액 1~2방울을 넣고 시약 1방울을 첨가합니다. 생성된 침전물을 두 부분으로 나누고 첫 번째 부분에 2M HCl 용액 1-2방울을 첨가하고 두 번째 부분에 2M 알칼리 용액 1-2방울을 첨가합니다. 반응 조건은 산성 환경, pH = 3에서 희석 용액을 사용하는 것입니다.
1.5.2.> Fe 2+를 Fe 3+로 산화. Fe 2+ 이온은 매우 강한 환원제이며 산성 환경에서 H 2 O 2, KMnO 4, K 2 Cr 2 O 7 등과 같은 여러 산화제의 작용으로 산화될 수 있습니다.
2Fe 2+ + 4OH – + H 2 O 2 → 2Fe(OH) 3 ↓.
체계적인 분석을 수행할 때 Fe 2+ 는 사전 테스트에서 발견되어야 합니다. 그룹 분리 과정에서 Fe 2+는 Fe 3+로 산화될 수 있습니다.
Fe 3+ 이온의 특정 분석 반응
1.5.3. Fe 3+ 양이온을 함유한 헥사시아노철산칼륨(II) K 4 는 "프러시안 블루"의 진한 파란색 침전물을 형성합니다.
4Fe 3+ + 3Fe(CN) 6 4– → Fe 4 3 ↓.
침전물은 산에는 거의 녹지 않지만 알칼리에 의해 분해되어 Fe(OH) 3 를 형성합니다. 시약을 초과하면 침전물이 눈에 띄게 용해됩니다. 반응을 실행합니다. FeCl3 용액 1~2방울에 시약 1방울을 첨가합니다. 결과 침전물을 두 부분으로 나눕니다. 한 부분에는 2M HC1 용액 2~3방울을 넣고, 다른 부분에는 2M NaOH 용액 1~2방울을 넣고 섞습니다.
1.5.4. Fe 3+ 이온과 함께 티오시안산칼륨(로다나이드) KNCS는 적혈구 복합체를 형성합니다. 티오시아네이트의 농도에 따라 다양한 조성의 복합체가 형성될 수 있습니다.
Fe 3+ + NCS – ← Fe(NCS) 2+ ,
Fe 3+ + 2NCS – ← Fe(NCS) 2+,
등. Fe 3+ + 6NCS – ← Fe(NCS) 6 3– ,
반응은 가역적이므로 시약이 과도하게 사용됩니다. Fe 3+와 안정한 복합체를 형성하는 이온(예: 불소 이온, 인산 염, 옥살산 및 구연산)에 의해 결정이 방해됩니다.
89. 그룹 I B의 요소. 가장 중요한 화합물의 일반적인 특성, 생물학적 역할. Ag+ 및 Cu 2+ 이온의 살균 효과. 은 및 구리 이온에 대한 분석 반응.
n = 4 Cu ns1(n-1)d10, 외부 레벨 - 1 ē,
사전 외부 - 18 ē
n = 5 Ag 짝이 없음 ē - 하나(실패, 미끄러짐), 하지만
n = 6 Au 18 - 전자 층, 하위 그룹에서 안정적
아연은 아직 완전히 안정화되지 않았으며
ē를 잃을 수 있으므로 CO가 가능합니다.
IB족의 d-원소만이 CO가 N족을 초과하는 화합물을 형성하며 Cu2+, Ag+, Au+3에 대해 더 안정적입니다.
이중 전하를 띤 구리 이온의 특징은 암모니아 분자와 결합하여 착 이온을 형성하는 능력입니다. 구리는 미량 원소 중 하나입니다. Fe, Cu, Mn, Mo, B, Zn, Co는 식물의 정상적인 기능에 소량이 필요하다는 사실 때문에 이 이름을 얻었습니다. 미량원소는 효소의 활성을 증가시키고 설탕, 전분, 단백질, 핵산, 비타민 및 효소의 합성을 촉진합니다. 은은 활성이 낮은 금속입니다. 대기 중에서는 실온이나 가열 시에도 산화되지 않습니다. 자주 관찰되는 은 물체의 흑화는 표면에 흑색 황화은(AgS 2)이 형성되어 발생한 결과입니다. 이는 공기 중에 포함된 황화수소의 영향으로 발생하며 은 물체가 황 화합물을 함유한 식품과 접촉할 때 발생합니다. 4Ag + 2H 2 S + O 2 -> 2Ag 2 S + 2H 2 O 전압 범위에서. , 은은 훨씬 더 많은 종류에 위치합니다. 따라서 염산과 묽은 황산은 영향을 미치지 않습니다. 은은 일반적으로 질산에 용해되며 다음 방정식에 따라 상호 작용합니다. Ag + 2HNO 3 -> AgNO 3 + NO 2 + H 2 O 은은 알칼리성일 때 무색 Ag + 양이온을 포함하는 일련의 염을 형성합니다. 은염 용액에 작용하면 AgOH를 얻을 것으로 예상할 수 있지만 대신 은(I) 산화물의 갈색 침전물이 침전됩니다. 2AgNO 3 + 2NaOH -> Ag 2 O + 2NaNO 3 + H 2 O 은(I ) 산화물, AgO 및 Ag 2 O 3 산화물이 알려져 있습니다. 질산은 (청금석) - AgNO 3 - 무색 투명한 결정을 형성하며 물에 잘 녹습니다. 은은 사진 재료 생산, 거울 제조, 전기 도금 및 의약품에 사용됩니다. 구리와 마찬가지로 은은 많은 수불용성 은 화합물(예: 산화은(I))을 형성하는 경향이 있습니다. - Ag 2 O 및 염화은(AgCl) 은 암모니아 수용액에 쉽게 용해됩니다. 갈바닉 은에는 복잡한 시안화은 화합물이 사용됩니다. 왜냐하면 이들 염 용액을 전기분해하는 동안 조밀한 미세 결정질 은층이 표면에 침착되기 때문입니다. 모든 은 화합물은 금속 유황 보루의 방출로 쉽게 감소됩니다. 유리 용기에 담긴 산화은(I)의 암모니아 용액에 환원제로 포도당이나 포르말린을 첨가하면 금속은이 유리 표면에 촘촘하고 반짝이는 거울층 형태로 방출됩니다. 은 이온은 박테리아의 발생을 억제하고 매우 낮은 농도에서도 식수를 살균합니다. 의학에서는 점막 소독을 위해 특수 첨가제(프로타르골, 칼라골 등)로 안정화된 은의 콜로이드 용액이 사용됩니다(구리, 주석, 수은과 같은 다른 중금속과 함께). 작은 농도에서의 효과(소위 올리고역학 효과). 뚜렷한 살균 효과(특정 박테리아를 확실하게 죽이는 능력)는 0.15 mg/l 이상의 은 이온 농도에서 관찰됩니다. 0.05 - 0.1 mg/l의 양에서 은 이온은 정균 효과(박테리아의 성장과 번식을 억제하는 능력)만을 갖습니다.은의 소독율은 오존이나 자외선에 비해 높지는 않지만 은이온이 물에 오랫동안 남아 있어 장기간 소독 효과를 발휘합니다.은의 작용 메커니즘은 아직 완전히 이해되지 않았습니다. 과학자들은 양전하를 띤 은과 구리 이온이 음전하를 띤 미생물 세포 표면과 정전기 결합을 형성할 때 소독 효과가 관찰된다고 믿습니다. 이러한 정전기 결합은 세포의 투과성을 손상시키고 중요한 양의 영양분이 세포 안으로 침투하는 것을 감소시킬 수 있는 장력을 생성합니다. 은과 구리 이온은 세포 내부로 침투하여 단백질의 일부이며 광합성 과정에 사용되는 아미노산과 상호 작용합니다. 결과적으로 태양 복사를 미생물의 음식과 에너지로 전환하는 과정이 중단되어 미생물이 사망하게됩니다. 수많은 연구 결과 바이러스뿐만 아니라 대부분의 병원성 미생물에 대한 은 이온의 효과적인 살균 효과가 나타났습니다. 확인되었습니다. 그러나 포자를 형성하는 다양한 미생물은 은에 거의 둔감합니다. 은 이온으로 물을 농축하는 방법은 물을 은 표면과 직접 접촉시키는 방법, 은염 용액으로 물을 처리하는 방법, 전해액을 사용하는 방법 등이 있습니다. 방법.
구리 이온에 대한 정성 반응
헥사시아노철산 칼륨(2) K 4는 구리염 용액과 함께 Cu 2의 적갈색 침전물을 형성하며 묽은 산에는 용해되지 않지만 암모니아 용액에는 용해됩니다.
Cu 2+ + 4+ ® Cu 2 ̅CuSO 4 용액 3방울에 K 4 염 용액 2방울을 첨가합니다. 붉은 침전물의 형성을 관찰한다. 침전물을 원심분리하고 암모니아 용액 3~5방울을 첨가한다.
구리 이온 검출을 위한 반응 Cu2+
그룹 시약 H2S의 작용. 황화수소는 구리염의 산성화된 용액에서 황화구리(II)의 검은 침전물을 형성합니다. CuS: CuSO4 + H2S = CuS + H2SO4,Cu2+ + H2S = CuS + 2H+.
수산화암모늄 NH4OH의 작용. 과량 섭취된 수산화암모늄 NH4OH는 구리염과 함께 강렬한 파란색의 테트라암민 구리(II)의 복합 양이온을 형성합니다.
CuSO4 + 4NH4OH = SO4 + 4H2O,
Cu2+ + 4NH4OH = + + 4H2O.
Ag+ 은이온 검출 반응
그룹 시약 HC1의 작용. 염산은 Ag+ 염 용액과 함께 물에 거의 용해되지 않는 염화은 AgCl의 흰색 침전물을 형성합니다.
Ag+ + Cl- = AgCl.
은 양이온 검출. 염산 및 그 염 용액(즉, Cl-염화 이온)은 Ag+ 염 용액과 함께 실질적으로 수불용성인 흰색 염화은 AgCl 침전물을 형성하며, 이는 과량의 NH4OH 용액에 잘 용해됩니다. 이 경우 수용성 복합 은염인 디암민 염화은이 형성됩니다. 질산의 후속 작용으로 착이온이 파괴되고 염화은이 다시 침전됩니다(은염의 이러한 특성을 사용하여 이를 감지합니다).
AgNO3 + HCl = AgCl + HNO3,
AgCl + 2NH4OH = Cl + 2H2O,
Cl + 2HNO3 = AgCl + 2NH4NO3.
90. II B 그룹의 요소. 가장 중요한 화합물의 일반적인 특성, 생물학적 역할. 구리 및 아연 함유 효소의 복잡한 특성. Zn 2+ 이온에 대한 분석 반응.
효소는 천연 단백질 촉매제입니다. 일부 효소는 순전히 단백질로 구성되어 있으며 활성을 나타내기 위해 다른 물질이 필요하지 않습니다. 그러나 특정 비단백질 화합물이 있을 때만 활성이 나타나는 대규모 효소 그룹이 있습니다. 이러한 화합물을 보조인자라고 합니다. 보조인자는 예를 들어 금속 이온이거나 복잡한 구조의 유기 화합물일 수 있으며 일반적으로 보조효소라고 합니다. 효소의 정상적인 기능을 위해서는 때때로 조효소와 금속 이온이 모두 필요하여 기질 분자와 함께 삼원 복합체를 형성한다는 것이 확립되었습니다. 따라서 금속은 생물학적 기계의 일부로서 대체할 수 없는 부품입니다. 인산 잔류물의 이동을 위해서는 마그네슘 이온이 필요하며, 동일한 목적을 위해서는 칼륨 이온도 필요합니다. 단백질의 가수분해에는 아연 이온 등이 필요합니다. 아래에서는 이러한 문제를 자세히 조사할 것입니다. 일반적으로 효소는 동일한 유형의 반응을 가속화하며 그 중 소수만이 하나의 특정 단일 반응에만 작용합니다. 절대적 특이성을 갖는 이러한 효소에는 특히 요소를 분해하는 요소분해효소가 포함됩니다. 대부분의 효소는 기질 선택에 있어서 그다지 엄격하지 않습니다. 예를 들어, 동일한 가수분해효소는 여러 가지 다른 에스테르의 가수분해 분해를 촉매할 수 있습니다. 생물학 연구의 화학적 측면이 심화되고 화학자가 생물학자의 보조자 및 협력자가 되면서 새로 발견된 효소의 수가 꾸준히 증가했습니다. 곧 그들은 수십 개가 아닌 수백 개로 계산되어야했습니다. 이러한 생물학적 촉매의 범위 확장으로 인해 효소의 분류 및 명명법에 약간의 어려움이 발생했습니다. 이전에는 효소가 작용하는 기질에 따라 끝에 "ase"를 추가하여 명명되었습니다. 따라서 효소가 설탕 맥아당에 작용하면 "말타아제"라고 부르고 유당에 작용하면 "락타아제"등으로 불립니다. 현재 이름이 효소의 화학적 기능을 반영하는 명명법이 채택되었습니다. "aza" 입자는 단순 효소용으로 예약되어 있습니다. 효소 복합체가 반응에 관여하는 경우 "시스템"이라는 용어가 사용됩니다.
효소는 6가지 클래스로 구분됩니다.
산화환원효소. 산화환원반응을 촉매하는 효소입니다. 산화환원효소의 예로는 피루브산에서 수소를 제거하는 피루브산 탈수소효소, 과산화수소를 분해하는 카탈라아제 등이 있습니다.









냉동 해산물 칵테일 만드는 법
회계 서비스 회사. 회계 서비스. 일반적인 운영 방식
개인 기업가를 위한 OKVED 활동 코드
개인 기업가를위한 보험료 : 지불시기 및 금액
통조림이 들어간 피자. 어린애가 들어간 피자. 시칠리아 피자를 만들려면 다음 재료를 준비해야 합니다.