МИНИСТЕРСТВО ОБРАЗОВАНИЯ, НАУКИ И МОЛОДЕЖИ
РЕСПУБЛИКИ КРЫМ
КРЫМСКОЕ РЕСПУБЛИКАНСКОЕ ВНЕШКОЛЬНОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ
«ЦЕНТР ЭКОЛОГО-НАТУРАЛИСТИЧЕСКОГО ТВОРЧЕСТВА
УЧАЩЕЙСЯ МОЛОДЕЖИ»
ОТКРЫТОЕ ЛАБОРАТОРНОЕ ЗАНЯТИЕ:
ИЗУЧЕНИЕ СТРОЕНИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ
Разработала:
Кузнецова Елена Юрьевна, методист высшей категории,
руководитель учебного коллектива
«Основы биологии», к.с.-х.н.
г. Симферополь, 2014 г.
Тема занятия : Изучение строения растительной клетки под микроскопом
Цель : закрепить и углубить знания об особенностях строения растительной клетки.
Тип занятия : лабораторное занятие
Используемые формы и методы : беседа, тестирование, работа с микроскопической техникой.
Вводимые понятия : клеточная стенка, ядро, вакуоль, хлорофилловые зерна, крахмальные зерна, плазмолиз, деплазмолиз.
Материалы и оборудование : микроскопы с принадлежностями, вода, 5% раствор поваренной соли, сочная чешуя лука, лист валлиснерии, картофель.
План проведения занятия :
Актуализация знаний. Тестирование.
Строение микроскопа и работа с микроскопической техникой.
Методика изготовления временных препаратов. Приготовление препарата эпидермы сочной чешуи лука, микроскопирование.
Постановка эксперимента. Явления плазмолиза и деплазмолиза.
Крахмальные зерна мякоти картофеля.
Хлорофилловые зерна листа валлиснерии.
Ход занятия :
1. Актуализация знаний. Тестирование .
Тестовые задания по теме «Строение растительной клетки»
1 Какие органеллы отсутствуют в животной клетке:
a ) митохондрии б) пластиды в) рибосомы г) ядро
2. В каких органеллах образуется первичный крахмал:
3. В каких органеллах происходит окислительное фосфорилирование:
a ) митохондрии б) хлоропласты в) ядро г) рибосомы
4. Какая группа липидов формирует основу клеточных мембран:
а) нейтральные жиры б) фосфолипиды в) воски г) каратиноиды
5. Растительная клетка, в отличие от животной, имеет:
а) эндоплазматический ретикулум б) комплекс Гольджи
в) вакуоль с клеточным соком г) митохондрии
6. Гранулярный эндоплазматический ретикулум отличается от агранулярного наличием:
а) центросом б) лизосом в) рибосом г) пероксисом
7. Митохондрии называют энергетическими станциями клетки. Такое название органелл связано с их функцией:
а) синтеза белков б) внутриклеточного пищеварения
в) транспорта газов, в частности кислорода г) синтеза АТФ
8. Запас питательных веществ клетки содержится в:
а) ядре б) хлоропластах в) ядрышке г) лейкопластах
9. В какой из этих органелл осуществляется фотофосфорилирование:




Строение микроскопа и работа с микроскопической техникой .

В состав механического устройства микроскопа входят штатив, предметный столик, осветительная система, кремальера, микромет-рический винт, тубус и револьвер.
На предметный столик кладется объект изучения. Под предметным столиком расположено осветительное устройство; в него входит двусто-роннее зеркальце. Собирая лучи, идущие от источника освещения, вогнутое зеркало отражает их в виде пучка лучей, который через отверстие в центре столика направляется на объект.
Оптическая система микроскопа состоит из окуляра, объектива и связывающего их тубуса. Объективы бывают двух родов: для малого и большого увеличения изображения. При необходимости сменить объектив пользуются револьвером – вогнутой круглой пластинкой с ввинченными в нее объективами. Вся оптическая система подвижна: поднимая ее вращением кремальеры против часовой стрелки или опуская ее вращением по часовой стрелке, находят положение, при котором объект становится видимым наблюдателю.
Строение микроскопа :
1 – окуляр; 2- револьвер для смены объективов; 3 – объектив;
4 – кремальера для грубой наводки;
5 – микрометрический винт для точной наводки; 6 – предметный столик; 7 – зеркало; 8 - конденсор
3. Методика изготовления временных препаратов. Приготовление препарата эпидермы сочной чешуи лука, микроскопирование .
Приготовить предметное стекло с каплей воды;
Из мясистой чешуи луковицы скальпелем вырезать небольшой кусочек (около 1 см 2) с внутренней (вогнутой) стороны, пинцетом или иглой снять прозрачную пленку (эпидермис). Положить в приготовленную каплю и наложить покровное стекло;
Изучить строение клетки при малом и большом увеличении;
Зарисовать одну клетку. Отметить клеточную стенку, постенный слой цитоплазмы, ядро, вакуоль с клеточным соком.

Строение растительной клетки
Постановка эксперимента. Явления плазмолиза и деплазмолиза .
Приготовить новый препарат из кожицы лука. Снять препарат со столика микроскопа, заменить воду под покровным стеклом 5% раствором поваренной соли (NaCl). Покровное стекло можно не снимать: каплю раствора нанести около него, чтобы она слилась с водой под стеклом, а потом с противоположной стороны приложить полоску фильтровальной бумаги. Раствор войдет под покровное стекло и заменит воду.
Мы поместили клетку в гипертонический раствор, т.е. концентрация раствора вне клетки превышает концентрацию веществ в клетке. При этом вода выходит из вакуоли, объем вакуоли уменьшается, цитоплазма отходит от оболочки и сокращается вместе с вакуолью. Наблюдается явление плазмолиза .
В зависимости от степени концентрации взятого раствора, быстроты обработки и формы клетки картины плазмолиза могут быть различными.
Если плазмолиз идет медленно в слабом растворе, содержимое клетки чаще всего вначале отходит от оболочки по концам клетки (уголковый плазмолиз), могут быть затронуты большие участки клетки (вогнутый плазмолиз). Содержимое клетки может обособиться в одну круглую каплю (выпуклый плазмолиз). При воздействии на клетку более крепкого раствора плазмолиз протекает быстрее, и возникают картины судорожного плазмолиза, при котором содержимое остается связанным с оболочкой многочисленными нитями Гехта.

Явление плазмолиза
А – Растительная клетка:
1 – клеточная стенка;
2 – вакуоль;
3 – постенный слой цитоплазмы;
4 – ядро.
Б – Д – Плазмолиз:
Б – уголковый;
В – вогнутый;
Г – выпуклый;
Д – судорожный
5 – нити Гехта
При плазмолизе клетка остается живой. Более того, показателем жизнеспособности клетки может служить способность ее к плазмолизу. При возврате клетки в чистую воду наступает деплазмолиз , при котором клетка опять поглощает воду, вакуоль увеличивается в объеме, и цитоплазма, прижимаясь к оболочке, растягивает ее.
Зарисовать разные стадии плазмолиза с соответствующими обозначениями.
Провести явление деплазмолиза, вытеснив из-под покровного стекла раствор соли с помощью воды и фильтровальной бумаги.
Крахмальные зерна мякоти картофеля
Крахмальные зерна - основной тип запасных питательных веществ растительной клетки. Образуются только в пластидах живых клеток, в их строме. В хлоропластах на свету откладываются зерна ассимиляционного (первичного) крахмала, образующиеся при избытке продуктов фотосинтеза – сахаров.
Приготовить препарат крахмальных зерен из мякоти картофеля. С этой целью на предметное стекло в каплю воды выдавить сок мякоти клубня картофеля. Рассмотреть под микроскопом, зарисовать.

Крахмальные зерна картофеля
Хлорофилловые зерна листа валлиснерии
Приготовить препарат из листа валлиснерии, поставив в центр поля зрения достаточно крупные клетки нижней трети листовой пластинки, недалеко от средней жилки. Рассмотреть этот участок под большим увеличением, зарисовать хлоропласты.

Хлоропласты в клетках листа валлиснерии
Выводы по занятию :
Установить отличия растительной и животной клеток;
Установить закономерности осмотических явлений в клетке.
Домашнее задание :
Разгадать кроссворд «Клеточное строение»

Кроссворд «Клеточное строение»
По горизонтали : 2 . Жидкое подвижное содержимое клетки. 5 . Главный органоид клетки. 8 . Составная часть микроскопа. 10 . Единица живого организма. 12 . Простой увеличительный прибор. 13 . Трубка в микроскопе, в которую вставлены увеличительные стекла. 16 . Создатель микроскопа. 18 . Физиологический процесс, свойственный живой клетке. 19 . То, на чем приготавливают препараты. 22 . Участок между клетками с разрушенным межклеточным веществом, заполненный воздухом.
По вертикали : 1 . Окулус (лат. ). 3 . Сложный оптический прибор. 4 . Тонкий участок в оболочке клетки. 6 . Главная структура ядра. 7 . Полость клетки, заполненная клеточным соком. 9 . Часть в верхнем конце тубуса микроскопа, состоящая из оправы и двух увеличительных стекол. 11 . Часть микроскопа, к которой прикреплен тубус. 14 . Покров клетки. 15 . Мелкие тельца в цитоплазме растительной клетки. 17 . Часть луковицы, из которой приготавливают препарат. 20 . Часть микроскопа, расположенная на нижнем конце тубуса. 21 . Водное растение, в клетках листа которого можно увидеть движение цитоплазмы.
Ход работы
Исследуют препараты, полученные из сырых и вареных овощей. Для получения препаратов из овощей от каждого экземпляра отделяют часть мякоти и разрезают ее пополам. Одну половину до снятия срезов хранят в холодной воде, другую варят до готовности. Для обеспечения сравнимости результатов срезы для микроскопирования снимают с тех мест мякоти, которые соприкасались друг с другом до разрезания перед варкой. Замоченные семена фасоли делят на две семядоли, одну из которых варят.
Для микроскопирования на каждое предметное стекло помещают по два препарата: с левой стороны – из сырых продуктов, с правой – из вареных, добавив к ним по капле воды. Каждый препарат рассматривают в неокрашенном и окрашенном виде. В качестве красителей для препаратов из овощей используют сафранин, который окрашивает пектиновые вещества в оранжево-желтый цвет, а клетчатку и хлопья денатурированных белков – в вишнево-красный, для крахмалосодержащих овощей используют, кроме того, йод. Окрашивание препаратов из фасоли производят только йодом, который окрашивает крахмальные зерна в сине-черный цвет, а белковую матрицу и клеточные стенки – в золотисто-желтый.
При окрашивании препаратов с них удаляют воду с помощью фильтровальной бумаги, наносят по капле краски и выдерживают в течение двух минут. Затем с препаратов снимают избыток красящего вещества и добавляют к ним по капле воды. На окрашенные и неокрашенные препараты кладут покровные стекла.
Микроскопирование препаратов производить сначала при малом увеличении, а затем при большом. Зарисовать препараты при большом увеличении.
1. Изучение строения тканей картофеля и корнеплодов .
Из середины очищенного клубня (корнеплода) вырезать ломтик толщиной 5 мм и разрезать его пополам. Одну половинку поместить в стакан с холодной водой, вторую – в стакан с кипящей водой и варить 10-15 мин. Из сырой и вареной частей клубня (корнеплода) вырезать, соблюдая симметрию, по одному брусочку поперечным сечением 5×5 мм. С помощью бритвенного лезвия сделать с торцевой стороны каждого брусочка по два прозрачных среза площадью 2-4 мм 2 . Перенести их иглой на три предметных стекла и добавить по капле воды.
Препараты на одном предметном стекле оставить неокрашенными, на другом – окрасить йодом, на третьем – сафранином и йодом. Препараты накрыть предметными стеклами и рассмотреть под микроскопом. Обратить внимание на форму клеток, плотность прилегания их друг к другу, состояние клеточных стенок, зерен крахмала в тканях сырого и вареного картофеля (корнеплодов).
2. Изучение строения тканей лука репчатого. От луковицы отделить мясистую чешую и разрезать ее пополам вдоль оси роста, одну половинку поместить в стакан с холодной водой, а другую сварить в течение 15 мин. С внутренней стороны сырых и вареных чешуек снять с помощью препаровальной иглы тонкую пленку. Полученные пленки расправить. Вырезать из наиболее тонких участков по два препарата площадью 2× 2 мм 2 и поместить их на два предметных стекла, добавив к каждому препарату по капле воды. Препараты на одном предметном стекле оставить неокрашенными, а на другом окрасить сафранином. Подготовленные препараты покрыть покровными стеклами и рассмотреть под микроскопом. Обратить внимание на толщину и состояние клеточных стенок, плотность прилегания их друг к другу, степень прозрачности содержимого клеток, наличие ядер. Отметить различия в строении тканей сырого и вареного лука, а также в структуре и интенсивности окраски отдельных элементов клеток.
Неокрашенные препараты использовать для наблюдения плазмолиза клеток. С препаратов снять покровные стекла, фильтровальной бумагой удалить воду и добавить несколько капель 10%-ного раствора поваренной соли, выдержать в течение 5-10 мин, накрыть покровными стеклами и вновь рассмотреть под микроскопом. Найти в поле зрения плазмолизованные клетки в препаратах сырого лука, объяснить отсутствие таких клеток в препарате из вареного лука. Сделать зарисовки.
3. Изучение строения тканей семян фасоли . Предварительно замоченное семя фасоли разделить на две семядоли, одну из которых варить в течение 1 ч. Из каждой семядоли сделать по два среза для приготовления препаратов, неокрашенных и окрашенных йодом. При рассмотрении препаратов под микроскопом обратить внимание на различие в структуре тканей сырых и вареных семян фасоли.
Сделать выводы о влиянии тепловой кулинарной обработки на структуру тканей овощей.
Задание №2. Изучить влияние технологических факторов на
Сохранность клеточных стенок картофеля при изготовлении
Картофельного пюре
Ход работы
Вариант 1. Оставшиеся от предыдущего исследования две боковые части клубня картофеля поместить в стакан с кипящей водой и варить в течение 20-25 мин. Одну часть в горячем состоянии растереть в ступке, другую охладить до комнатной температуры и также растереть.
Приготовить препараты для микроскопирования. На предметное стекло перенести препаровальной иглой немного того и другого пюре, добавить по капле раствора йода и накрыть покровными стеклами. При рассмотрении препаратов при малом увеличении сравнить количество клеток с разрушенными клеточными стенками в том и другом пюре. Рассмотреть препараты при большом увеличении и зарисовать. Сделать вывод о влиянии температуры вареного картофеля при его протирании на степень сохраняемости клеточных стенок.
Вариант 2. Провести сравнительное микроскопирование сухого картофельного пюре и восстановленного жидкостью с последующим перемешиванием и без него.
Отвесить две пробы сухого пюре массой по 25 г и поместить их в два стакана. В двух других стаканах нагреть до 78 - 80°С по 100 см 3 воды и залить ею сухое пюре. Один стакан закрыть часовым стеклом и выдержать пюре в течение 2 мин для набухания. Приготовить для микроскопирования препараты из сухого пюре и восстановленного. Концом стеклянной палочки, смоченной водой, взять немного сухого пюре и поместить на предметное стекло, добавить каплю воды, затем окрасить йодом, накрыть покровным стеклом и рассмотреть под микроскопом. Отметить наличие в сухом пюре клеток с разрушенными клеточными стенками. Из восстановленного пюре приготовить препараты и рассмотреть их под микроскопом, как указано в варианте 1.
Сопоставить количество клеток с разрушенными клеточными стенками, в пюре из свежего картофеля, протертого в горячем состоянии, и в сухом пюре, а также в восстановленном пюре. Зарисовать препараты.
Цель: Ознакомиться со строением крахмальных зерен основных пищевых растений
Методические указания. Наиболее распространенное запасное вещество растений – полисахарид крахмал. Первичный крахмал образуется из продуктов фотосинтеза в листьях растений и имеет вид мелких крупинок. Здесь он не хранится, а транспортируется для построения органов растений или откладывается в виде запасного вещества в плодах.
Рис. 6. Крахмальные зерна различных видов растений
А – из клубней картофеля: 1 – простое; 2 – сложное; 3 – полусложное;
Б – пше-ница (простое); В – овес (сложное); Г – кукуруза (простое);
Д – рис (сложное); Е – гречиха (простое)
Здесь он не хранится, а транспортируется для построения органов растений или откладывается в виде запасного вещества в плодах.
Вторичный или запасной крахмал образуется в лейкопластах (амилопластах) в специализированных органах – корневищах, клубнях, семенах, плодах. Из этого крахмала образуются простые, полусложные и сложные зерна.
Если в лейкопласте имеется одна точка, вокруг которой откладываются слои крахмала, то формируется простое крахмальное зерно (рис. А1, Б, Г).
Сложное зерно образуется, если точек отложения две и больше (рис. А2; В, Д, Е).
Полусложные зерна образуются в том случае, если крахмал сначала откладывается вокруг нескольких точек, а затем после их соприкосновения образуются общие слои (рис.6,А3). Простые крахмальные зерна имеют пшеница, рожь, кукуруза, сложные – рис, овес, гречиха. В клубнях картофеля встречаются все три типа крахмальных зерен. Форма, размер, строение крахмальных зерен специфичны для каждого вида растений. Поэтому при анализе продовольственного сырья растительного происхождения, в частности муки, по строению крахмальных зерен можно идентифицировать и установить в них наличие примесей.
Задание: Изготовить препараты крахмальных зерен картофеля, пшеницы, овса, риса, гречихи. Произвести окраску (реакцию) раствором йода. Зарисовать при большом увеличении крахмальные зерна, указанных выше растений, сохраняя при этом между ними пропорции. Подписать рисунки, указав вид растения и тип крахмальных зерен.
Последовательность выполнения работы:
Крахмальные зерна картофеля. Отрезают небольшой кусочек клубня и делают им мазок по предметному стеклу с предварительно нанесенной на него каплей воды. Каплю накрывают покровным стеклом, микроскопируют при малом, затем при большом увеличении. Необходимо постараться найти все три типа крахмальных зерен (иногда этого сделать не удается). При рассмотрении слоистости крахмальных зерен прикрывают диафрагму и слегка вращают микровинт. Зарисовать увиденную картину.
Осуществляют окраску препарата раствором йода и, глядя в микроскоп, наблюдают процесс окрашивания.
Препараты крахмальных зерен пшеницы, овса, риса и гречихи лучше готовить из разбухших семян. При этом, разрезав зерновку, извлекают содержимое ее (эндосперм) и переносят его в каплю воды на предметное стекло. Далее поступают, как в предыдущем случае, и рассматривают при большом увеличении.
Необходимо зарисовать форму крахмальных зерен пшеницы, овса, риса и гречихи. Необходимо научиться дифференцировать их по строению и определять видовую принадлежность.
Клубни отличаются от корневищ тем, что у них стебель короткий и толстый, а листья недоразвиты. Как и на всяком побеге, у них имеются почки и расположены они на верхушке и в пазухах недоразвитых листьев. Придаточные корни на клубнях не развиваются. Клубни у картофеля вырастают из подземных почек не сразу. Сначала из почки растёт длинный белый подземный побег — столон. Столон живёт меньше года. Верхушка со временем начинает утолщаться и превращается к осени в клубень.
В клубне накапливается много крахмала в виде мелких зёрен. Клубень картофеля — это видоизменённый побег с утолщённым стеблем и мелкими листьями.
Что делать. Рассмотрите внешнее строение клубня картофеля.
Что наблюдать. Найдите на его поверхности верхушечную и пазушные почки (глазки), рубцы от листьев (бровки) и рубец от отделившегося столона.
Что делать. Подсчитайте число глазков на клубне.
Что наблюдать. Найдите на клубне верхушку и основание.

Обратите внимание на неравномерное распределение глазков на утолщённом стебле.
Ту часть клубня, где больше глазков, называют верхушкой, а противоположную где рубец от столона — основанием.
Что делать. Разрежьте клубень на две части. На разрез клубня капните каплю раствора иода.
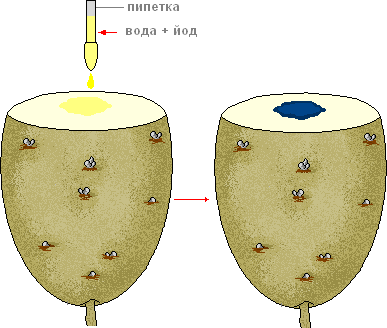
- Как изменилась окраска разреза клубня?
- Какие вещества отложены в клетках клубня?
- Каково значение клубня в жизни растения?
Подготовить к отчёту. Зарисуйте в тетради внешний вид клубня и подпишите его части. Запишите признаки, доказывающие, что клубень — это побег.
Ткань (мякоть) картофеля, овощей и плодов состоит из тонкостенных клеток, разрастающихся примерно одинаково во всех направлениях. Такую ткань называют паренхимной. Содержимое отдельных клеток представляет собой полужидкую массу - цитоплазму, в которую погружены различные клеточные элементы (органеллы) - вакуоли, пластиды, ядра, крахмальные зерна и др. (рис. 9.2). Все органеллы клетки окружены мембранами. Каждая клетка покрыта оболочкой, представляющей собой первичную клеточную стенку.
Оболочки каждых двух соседних клеток скрепляются с помощью срединных пластинок, образуя остов паренхимной ткани (рис. 9.3).
Контакт между содержимым клеток осуществляется через плазмодесмы, которые представляют собой тонкие цитоплазматические тяжи, проходящие через оболочки.
Поверхность отдельных экземпляров овощей и плодов покрыта покровной тканью - эпидермисом (плоды, наземные овощи) или перидермой (картофель, свекла, репа и др.).
Поскольку в свежих овощах содержится значительное количество воды, то все структурные элементы их паренхимной ткани в той илиЧшой степени гидратированы. Вода как растворитель оказывает важное влияние на механические свойства растительной ткани. Гидратируя в той или иной степени гидрофильные соединения, она пластифицирует структуру стенок и срединных пластин. Это обеспечивает достаточно высокое тургорное давление в тканях.
Тургор - состояние напряжения, возникающее вследствие давления содержимого клеток на их эластичные оболочки и давления оболочек на содержимое клеток.
Тургорное давление может снижаться, например, при увядании или подсыхании овощей и плодов или возрастать, что наблюдается при погружении увядших овощей в воду. Это свойство овощей и плодов можно учитывать при их кулинарной переработке. Так, картофель и корнеплоды с ослабленным тур-гором перед механической очисткой рекомендуют замачивать в течение нескольких часов для сокращения времени обработки и снижения количества отходов.
Рис. 9.2. Строение растительной клетки
Рис. 9.3. Стенка растительной ткани:
1 -- срединная пластинка; 2 - плазмалемма.
Увеличение х 45000 (по Ж.-К. Ролан, А. Сёлеши, Д. Сёлеши)

Вакуоль - самый крупный элемент, расположенный в центре клетки. Она представляет собой своеобразный пузырек, заполненный клеточным соком, и является наиболее гидратированным элементом клетки паренхимы овощей и плодов (95...98 % воды). В состав сухого остатка клеточного сока входят в том или ином количестве практически все водорастворимые пищевые вещества.
Основная масса Сахаров, содержащихся в картофеле, овощах и плодах в свободном состоянии, растворимого пектина, органических кислот, водорастворимых витаминов и полифенольных соединений концентрируется в вакуолях.
В клеточном соке содержится примерно 60... 80 % минеральных веществ от общего их количества в овощах и плодах. Соли одновалентных металлов (калия, натрия и др.) практически полностью концентрируются в клеточном соке. Солей же кальция, железа, меди, магния содержится в нем несколько меньше, так как они входят в состав других элементов тканей.
Клеточный сок содержит как свободные аминокислоты, так и растворимые белки, которые образуют в вакуолях растворы относительно слабой концентрации.
Тонкий слой цитоплазмы с другими органеллами занимает в клетке пристенное положение. В состав цитоплазмы входят в основном белки, ферменты и в небольшом количестве липиды (соотношение белков и липидов 90:1). В цитоплазме, как и в вакуолях, они находятся в виде раствора, но более концентрированного (10 %).
Пластиды - это органеллы, которые присутствуют только в растительных клетках. Наиболее типичные из них - хлоропласты, которые содержат хлорофилл. В определенных физиологических условиях пластиды не образуют хлорофилл; в этих случаях они вырабатывают либо белки (протеопласты), либо липиды и пигменты (хромопласты), но чаще всего такие пластиды выполняют резервные функции, и тогда в них накапливается крахмал (амилопласты), поэтому пластиды бывают окрашенными и бесцветными. Последние называют лейкопластами.
В состав хлоропластов кроме хлорофилла входят белки и липиды в соотношении 40:30, а также крахмальные зерна.
В процессе развития хромопластов образуются крупные глобулы, или кристаллы, содержащие каротиноиды, в том числе и каротины. Присутствие этих пигментов в зеленых овощах и некоторых плодах (крыжовник, виноград, слива ренклод и др.) обусловливает различные оттенки их зелено-желтой окраски. Каротины придают желто-оранжевую окраску моркови, репе и др. Однако не всегда оранжевая окраска указывает на высокое содержание их в плодах и овощах; например, окраска апельсинов, мандаринов обусловлена другим пигментом - криптоксантином. В то же время в зеленых овощах относительно высокое содержание каротина может быть замаскировано хлорофиллом.
Амилопласты заполнены в основном крупными гранулами крахмала. Следует отметить, что в растительных клетках все содержащиеся в них крахмальные зерна находятся в пространстве, ограниченном оболочкой амилопластов или других пластид.
Ядро клетки содержит хроматин (деспирализованные хромосомы), состоящий из ДНК и основных белков (гистонов), и ядрышки, богатые РНК.
Мембраны - это активный молекулярный комплекс, способный осуществлять обмен веществ и энергии.
Цитоплазма на границе с клеточной оболочкой покрыта простой мембраной, называемой плазмалеммой. Внешнюю гра-ни1ДУ плазмалеммы можно увидеть при рассмотрении под микроскопом препаратов растительной ткани, обработанных концент рированным раствором поваренной соли. Из-за разности между осмотическим давлением внутри клетки и вне ее происходит переход воды из клетки в окружающую среду, вызывающий плазмолиз - отделение цитоплазмы от клеточной оболочки. Аналогично плазмолиз можно вызвать, обрабатывая срезы растительной ткани концентрированными растворами Сахаров или кислот.
Цитоплазматические мембраны регулируют клеточную проницаемость, избирательно задерживая либо пропуская молекулы и ионы тех или иных веществ в клетку и за ее пределы.
Вакуоль, как и цитоплазма, также окружена простой мембраной, называемой тонопластом.
Основные структурные компоненты мембран - белки и полярные липиды (фосфолипиды). Существуют различные типы строения цитоплазматической мембраны: трехслойное (из двух слоев белка с биомолекулярной прослойкой липидов), гранулярное (из частиц, диаметр которых составляет около 100 Ю- 10 м, или из более мелких частиц - субъединиц). В настоящее время мембрану рассматривают как жидкую структуру, пронизанную белками.
Поверхность ядер, пластид и других цитоплазматических структур покрыта двойной мембраной, состоящей из двух рядов простых мембран, разделенных перинуклеарным пространством. Эти мембраны препятствуют также смешиванию содержимого двух соседних органелл. Отдельные вещества переходят из одних органелл в другие лишь в строго определенных количествах, необходимых для протекания физиологических процессов в тканях.
Клеточные оболочки в совокупности со срединными пластинками называют клеточными стенками. В отличие от мембран они характеризуются полной проницаемостью.
Клеточные стенки составляют 0,7...5,0 % сырой массы овощей и плодов. Так, в овощах плодовой группы, например в кабачках, количество их не превышает 0,7 %. В листовых овощах - белокочанной капусте, салате, шпинате - около 2 %. Наибольшим содержанием клеточных стенок отличаются корнеплоды - 2...4%.
В состав клеточных стенок входят в основном полисахариды (80...95 %) - клетчатка, гемицеллюлозы и протопектин, поэтому их часто называют углеводами клеточных стенок. В состав клеточных оболочек входят все перечисленные выше полисахариды. Считают, что срединные пластинки состоят в основном из кислых полисахаридов (протопектина), играющих роль межклеточного цементирующего вещества, которому иногда сопутствуют протеиновые соединения, а в наиболее старых тканях - лигнин.
Таб.9.1. Содержание экстенсина и оксипролина
в клеточных стенках некоторых растительных продуктов (%)
Кроме углеводов в клеточных стенках содержатся азотистые вещества, лигнин, липиды, воска, минеральные вещества.
Из азотистых веществ в клеточных стенках растительной ткани обнаружен структурный белок экстенсии - полимер из группы гликопротеидов, белковая часть которого связана с углеводами - остатками арабинозы и галактозы. Молекулярная масса белковой части таких макромолекул равна 50 000, экстенсии имеет форму жесткого стержня, на 50 % состоит из оксипролина. В клеточной стенке присутствует несколько фракций белка, различающихся содержанием оксипролина.
Экстенсии в некоторых отношениях напоминает белок коллаген, выполняющий аналогичные функции в животных тканях. Содержание экстенсина и оксипролина в клеточных стенках различных овощей и картофеля неодинаково (табл. 9.1). Клеточные стенки картофеля состоят примерно на 1/5 из экстенсина. В клеточных стенках корнеплодов его содержится в 2 раза меньше, чем в клеточных стенках картофеля; в клеточных стенках дыни содержание экстенсина не превышает 5 %.
Соотношение углеводов и экстенсина в клеточных стенках зависит от вида растительной ткани. Клеточные стенки многих растительных продуктов состоят примерно на 1/3 из целлюлозы, на 1/3 из гемицеллюлоз и на 1/3 из пектиновых веществ и белка. В клеточных стенках томатов между углеводами и белком существует другое соотношение -1:1.
Лигнин - природный полимер сложного строения, формирующий клеточные стенки растений. Играет роль инкрустирующего вещества, скрепляющего волокна целлюлозы и гемицеллюлоз. Ковалентно связан с полисахаридами гемицеллюлоз (кспланом), с пектиновыми веществами и белком. Содержание лигнина в тканях растений зависит от их вида и степени одревеснения. Значительное количество лигнина содержится в клеточных стенках свеклы, моркови, меньше его накапливается в белокочанной капусте.
В связи с тем, что размягчение картофеля, овощей и плодов, происходящее в процессе их тепловой кулинарной обработки, связывают с деструкцией клеточных стенок, представляется целесообразным рассмотреть строение последних.
По современным представлениям, клеточная стенка - это высоко специализированный агрегат, состоящий из различных полимеров (целлюлозы, гемицеллюлоз, пектиновых веществ, белков и др.), структура которых у разных растений закодирована с той же степенью точности, что и структура молекул белков.
На рис. 9.4 представлена модель структуры первичной клеточной стенки.
Первичная клеточная стенка состоит из волокон (микрофибрилл) целлюлозы, которые занимают менее 20 % объема гидратированной стенки. Располагаясь в клеточных стенках параллельно, целлюлозные волокна с помощью водородных связей образуют мицеллы, которые имеют правильную, почти кристаллическую упаковку. Одна мицелла целлюлозы может отстоять от другой на расстоянии, равном десяти ее диаметрам. Пространство между мицеллами целлюлозы заполнено аморфным основным веществом (матриксом), состоящим из пектиновых веществ, гемицеллюлоз (ксилоглюкан и арбиногалантан) и структурного белка, связанного с тетрасахаридами.
Первичная стенка клетки рассматривается как целая мешкообразная макромолекула, компоненты которой тесно взаимосвязаны. Между мицеллами целлюлозы и ксилоглюканом существуют многочисленные водородные связи. В свою очередь, ксилоглюкан ковалентно связан с боковыми галактановыми цепями пектиновых веществ, а пектиновые вещества через арабиногалактан ковалентно связаны со структурным белком.
Учитывая, что клеточные стенки многих овощей и плодов отличаются относительно высоким содержанием двухвалентных катионов, в основном Са и Mg (0,5... 1,0 %), между пектиновыми молекулами, содержащими свободные карбоксильные группы, могут возникать хелатные связи в виде солевых мостиков.
Рис. 9.4. Структура первичной клеточной стенки (по Альберсхейму):
1 - микрофибрилла целлюлозы: 2 - ксилоглюкан; 3 - главные
рамногалактуроновые цепи пектиновых веществ; 4 - боковые
галактановые цепи пектиновых веществ; 5- структурный белок
с арабинозными тетрасахаридами; 6- арабиногалактан

Вероятность образования солевых мостиков и степень этерификации полигалактуроновых кислот связаны обратной зависимостью. Солевые мостики способствуют упрочнению клеточных стенок и паренхимной ткани в целом.
Покровные ткани клубней картофеля, корнеплодов и других овощей характеризуются пониженной пищевой ценностью из-за концентрации в них клетчатки и гемицеллюлоз, поэтому при кулинарной обработке картофеля и большинства овощей эти ткани удаляют.











Самые важные даты и события в истории россии
Как приготовить свиные уши
Сметанные лепешки в духовке без дрожжей Как сделать сметанные лепешки
Курица на сковороде в сметанном соусе: рецепты с фото
Виски с содовой — как приготовить коктейль